含氮有机化合物是合成医药、农药、含能材料等精细有机化合物的中间体, 它不仅具有重要的实用价值, 而且在一些相关的功能材料研究中也是不可缺少的重要化合物[1]。氮杂环化合物结构中含有大量N—N、C—N键及较大的环张力, 因而具有很高的生成焓, 同时还具有密度高以及对环境友好等特征, 这类化合物中氮、氧原子的电负性高, 尤其氮杂芳环体系还能形成类苯结构的大π键, 具有钝感、热稳定性好的特点, 在含能材料的研究中备受重视[2-3]。
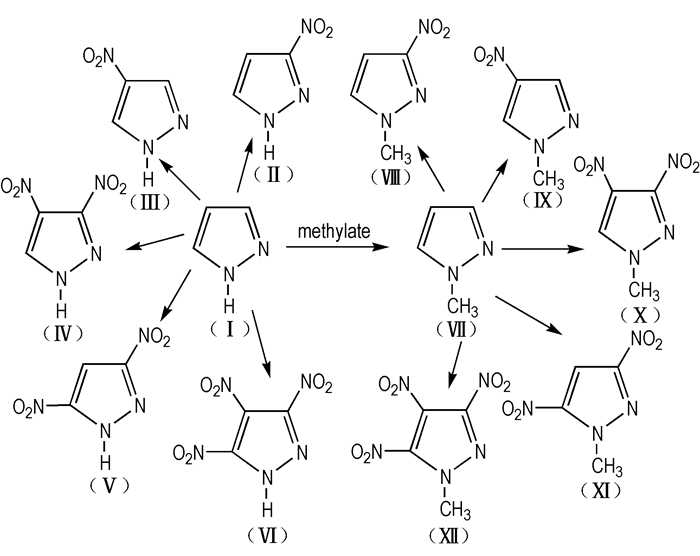
氮杂环唑类化合物在医药、农药、材料等众多领域具有广阔的应用, 颇受人们的青睐[4-6], 吡唑及其衍生物就是其中重要的一类化合物。吡唑及其衍生物是具有芳香性的稳定物质, 其显著的特点是耐氧化、耐热、耐水解[7], 可广泛应用于医药、农药、光敏材料、精细化工等方面[8]。吡唑结构上存在π-电子体系, 环上易于进行亲电取代、硝化、碘化、卤化等反应, 经硝化之后便可得到硝基吡唑。硝基吡唑衍生物氮元素的质量分数高于碳氢, 普遍具有生成焓高、感度较低、热稳定性好、环境友好等优点, 是一类高密度、高能量、低感度的耐热炸药, 该类化合物易于制备, 性能优良, 与大多数含能材料相容性好, 是一类具有潜在应用价值的候选含能催化剂[9]。Scheme 1为12种典型硝基吡唑化合物的结构。
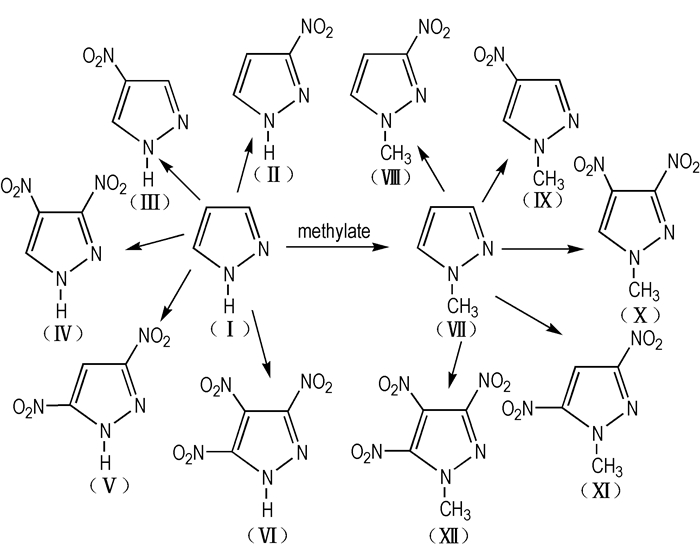
|
Scheme1 Structures of the 12 kinds of nitropyrazoles |
Scheme 1中的3,4-二硝基吡唑(Ⅳ)、3,5-二硝基吡唑(Ⅴ)、3,4,5-三硝基吡唑(Ⅵ)、1-甲基-3,4-二硝基吡唑(Ⅹ)、1-甲基-3,5-二硝基吡唑(Ⅺ)和1-甲基-3,4,5-三硝基吡唑(Ⅻ)含有二个以上硝基, 属于能量较高的含能化合物; Ⅳ、1-甲基-3-硝基吡唑(Ⅷ)、1-甲基-4-硝基吡唑(Ⅸ)、Ⅹ、Ⅺ和Ⅻ属于熔点低于100 ℃的含能化合物。其中, Ⅷ、Ⅸ的熔点虽然低于100 ℃, 但是它们的密度和能量也比较低。
Dalinger等[10-12]和Ravi等[13-16]对化合物Ⅵ、Ⅹ、Ⅺ、Ⅻ的合成及性能进行了报道, 并表明它们具有能量密度较低的性能, 尤其1-甲基-3,4,5-三硝基吡唑(Ⅵ, MTNP)的性能优良, 是潜在的熔铸炸药载体。2013年, 李雅津等[17]在国内首次合成出了Ⅻ, 采用的方法是甲基吡唑碘化再硝化, 但产率较低, 且产生中间体碘代物的过程会污染环境, 因此, 需要进一步改进其合成工艺。李雅津[18]和仪建红等[19]对硝基吡唑类化合物进行了相关的理论计算, 表明硝基吡唑类炸药具有良好的爆轰性能, 是新型高能量密度材料化合物。为此, 本文参考国内外文献, 综述了12种硝基吡唑的合成方法, 并进行了比较说明, 重点介绍了能量高于TNT、感度低于TNT或能量更高的吡唑类低熔点系列含能化合物, 如3,4-二硝基吡唑(3,4-DNP)、1-甲基-3,4,5-三硝基吡唑(MTNP), 期望为高密度、高能量、低感度炸药以及可替代TNT的熔铸炸药载体的进一步研究提供帮助。
2 硝基吡唑衍生物 2.1 硝基吡唑类化合物的合成及应用 2.1.1 3-硝基吡唑(3-NP,Ⅱ)Ⅱ的熔点174~175 ℃、爆速7.02 km·s-1、爆压20.08 GPa、密度1.57 g·cm-3[19], 可用作含能材料及进一步制得其它含能材料化合物的中间体。
1970年, Janssen等[20]合成得到了Ⅱ, 方法是将N-硝基吡唑溶解到苯甲醚中, 145 ℃下油浴反应10 h, 冷却析出白色结晶固体, 过滤、减压干燥得到化合物Ⅱ的粗品, 苯重结晶得Ⅱ的纯品。
2004年, 李翠屏等[8]将吡唑加入硝酸-硫酸的混合介质中, 保持温度不超过15 ℃的条件下反应3.5 h, 得到N-硝基吡唑, N-硝基吡唑于正辛醇中185~190 ℃加热回流, 得到转位产物Ⅱ, 合成线路如Scheme 2。
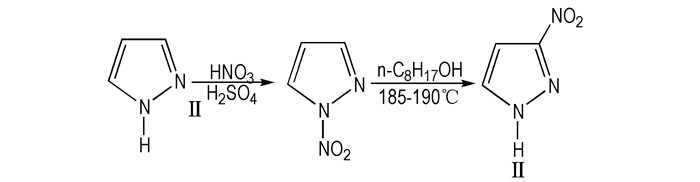
|
Scheme2 Synthetic route of 3-NP[8] |
2008年, 李洪丽等[9]将吡唑加入冰醋酸、浓硝酸和醋酸酐体系, 室温下反应, 得到N-硝基吡唑, N-硝基吡唑在苯甲腈中回流, 得Ⅱ。近年来, 国外的学者没有对该物质进一步的研究。
上述合成路线中, 均由N-硝基吡唑重排形成目标物3-硝基吡唑, 重排所用高沸点溶剂分别为苯甲醚、正辛醇和苯甲腈(对应沸点分别为155.5, 194.5, 190.7 ℃), 苯甲醚沸点较低, 重排反应需要较长时间; 苯甲腈和正辛醇作溶剂, 有利于提高回流温度, 缩短反应时间, 采用正辛醇作为反应介质时产品质量较差, 可能是高温条件下正辛醇受到氧化所致; 而用苯甲腈作为介质可以避免时间长、质量差等缺点。因此, 应考虑选用苯甲腈为反应介质[9]。
2.1.2 4-硝基吡唑(4-NP,Ⅲ)Ⅲ的熔点为163~165 ℃、密度1.52 g·cm-3、爆速6.86 km·s-1、爆压为18.81 GPa[19], 可作为含能材料中间体。
1988年, Kanishchev等[21]将吡唑加入硝硫混酸中, 110 ℃下反应48 h得到物质Ⅲ; 2013年, Rao等[22]将1-硝基吡唑加入H2SO4中, 室温下搅拌20 h, 反应混合液倒入冰水中, 乙醚萃取, 硫酸钠干燥有机层, 蒸馏得到无色固体物质Ⅲ, 乙醚/己烷重结晶得纯净物Ⅲ, 反应式如Scheme 3所示。
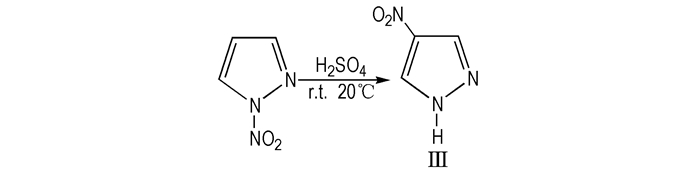
|
Scheme3 Synthetic route of 4-NP[21] |
3,4-DNP是多氮杂环含能化合物的典型代表, 其熔点为86~88 ℃、爆速为8.10 km·s-1、爆压为29.4 GPa, 密度为1.87 g·cm-3[20], 与TNT(熔点81℃、爆速6.856 km·s-1、爆压21.0 GPa、密度1.66 g·cm-3[23])相比, 3,4-DNP具有密度高、熔点低、爆速高等优点。
汪营磊[24]以吡唑为原料, 经在冰醋酸和发烟硝酸N-硝化、苯腈中热重排、硝硫混酸中C-硝化等三步反应合成了目标物Ⅳ, 热重排得率为92.67%, 蒋秋黎[25]对其热行为及与其它组分的相容性进行了研究, 结果表明Ⅳ具有较好的热稳定性, 能与DNAN(2,4-二硝基苯甲醚)、TNAZ(1,3,3-三硝基氮杂环丁烷)、RDX、HMX、CL-20、AP、A1和微晶蜡相容; 田新等[26-27]也经三步反应得到目标物Ⅳ, 并探讨了N-硝基吡唑重排为3-硝基吡唑过程中, 高沸点溶剂苯甲腈和苯甲醚对产率的影响, 结果发现在苯甲腈中、反应温度180 ℃、反应时间为3 h的条件下, 产物得率为91%, 在苯甲醚中、反应温度150 ℃、时间9 h的条件下得率为62%, 苯甲腈作介质的效果较好; 杜闪等[28-30]将吡唑溶解在冰醋酸、发烟硝酸和Ac2O中硝化得N-硝基吡唑; 将N-硝基吡唑溶解在正辛醇中, 加热回流, 185~190 ℃下热重排, 得3-硝基吡唑, 得率87.8%;将发烟浓硝酸和浓硫酸组成的混酸溶液慢慢滴加到3-硝基吡唑和浓硫酸组成的溶液中, 反应1 h后处理得Ⅳ(Scheme 4), 该工艺已经较成熟, 已能够提供公斤级的样品[31], 其以后的研究重点主要是新的绿色合成线路的探索及其与其它炸药组分的组合, 满足现代的混合炸药的新要求。
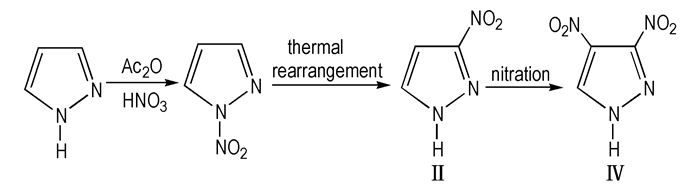
|
Scheme4 Synthetic route of 3,4-DNP |
上述路线均经过吡唑硝化为N-硝基吡唑、重排为3-硝基吡唑、再硝化得3,4-二硝基吡唑三步。不同处是重排过程中所用的高沸点溶剂, 分别为苯腈、苯甲腈和正辛醇, 重排产物得率依次为92.67%、91%和87.8%, 苯腈毒性较正辛醇毒性大, 但两者均有强烈的刺激性气味, 后处理较难。乙二醇的沸点为197 ℃, 是无色无臭, 绿色的高沸点溶剂, 目前还没有文章报道使用该溶剂为重排溶剂, 以后的实验研究中可以尝试用之代替毒性较大的苯腈。
2.1.4 3,5-二硝基吡唑(3,5-DNP,Ⅴ)Ⅴ的熔点为173~174 ℃、爆速8.34 km·s-1、爆压30.67 GPa、密度1.80 g·cm-3、分解温度316.8 ℃[32], 且分子呈对称分布, 比较稳定, 可以作为一种单质炸药, 也可以作为一种关键中间体用于不敏感炸药的合成。
1973年, Janssen等[33]将1,3-二硝基吡唑溶在苯腈中重排, 得到的混合物用己烷稀释并用NaOH溶液萃取, 得到含少量5-硝基吡唑的产物, 用苯结晶得到Ⅴ的纯净物, 测熔点为173~174 ℃。
2007年, 汪营磊等[34]合成了3,5-二硝基吡唑, 方法是向溶有3-硝基吡唑的冰醋酸中滴加浓硝酸和醋酸酐, 反应结束后倒入碎冰, 析出白色固体, 过滤、洗涤、干燥得1,3-二硝基吡唑; 将1,3-二硝基吡唑溶在苯腈中, 油浴加热至147 ℃, 保温77 h, 冷却至室温, 通氨气, 得到3,5-二硝基吡唑铵盐, 溶于水, 并用盐酸中和, 乙醚萃取, 无水Mg2SO4干燥, 过滤, 除去乙醚得到3,5-二硝基吡唑, 水重结晶, 得纯物质Ⅴ。其主要合成线路见Scheme 5。
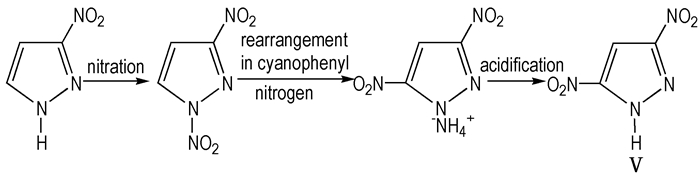
|
Scheme5 Synthetic route of 3,5-DNP |
2007年, 成健[35]也研究了不同硝化体系中的3,5-二硝基吡唑的合成, 主要以吡唑为原料, 经过硝化、σ重排、硝化和σ重排四步反应得到目标产物Ⅴ。该法中提到的N2O5硝化剂, 具有以下优点:温度易控制, 反应基本不放热, 无需废酸处理, 产物分离简单, 不发生氧化等副反应, 符合现代绿色化学的需求, 对该类绿色硝化剂的研究应用将是以后的研究热点。Scheme 5路线中二硝基吡唑铵盐的合成优化了后处理的条件, 但反应时间较长, 因此, 采用绿色硝化剂N2O5的方法将会是以后合成目标物Ⅴ的较优方法。
2.1.5 3,4,5-三硝基吡唑(TNP,Ⅵ)Ⅵ的熔点188~190 ℃、爆速9.00 km·s-1、爆压37.09 GPa和密度1.89 g·cm-3, 显弱酸性, 其在260~350 ℃范围内能够热分解, 分解热只有255 J·g-1[12]。它是至今为止所有完全硝化芳香族系统中(如:呋咱、氧化呋咱等)热稳定性和化学稳定性最好的化合物[38]。
2009年, Dalinger等[10]将5-氨基-3,4-二硝基吡唑溶在H2SO4中, 0~5 ℃的条件下加入H2O2, 将混合液加热至室温, 反应结束后将反应液倒入碎冰中, 乙醚反复萃取, Mg2SO4干燥, 真空中浓缩得到Ⅵ。
2010年, Herve[12]等, 提出了三种合目标物Ⅵ的方法, 分别为:
① 用4-氨基-3,5-二硝基吡唑和5-氨基-3,4-二硝基吡唑经H2S2O8氧化得到Ⅵ;
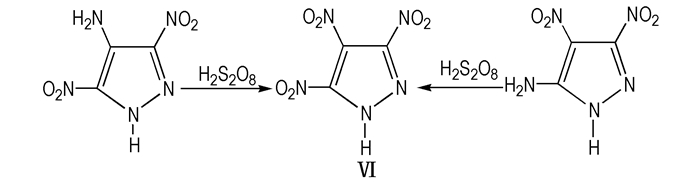
|
Scheme6 Oxidation of aminodinitropyrazoles to give TNP |
② 将5-氨基-3,4-二硝基吡唑在20%的H2SO4和亚硝酸钠中重氮化后再硝化得到Ⅵ;
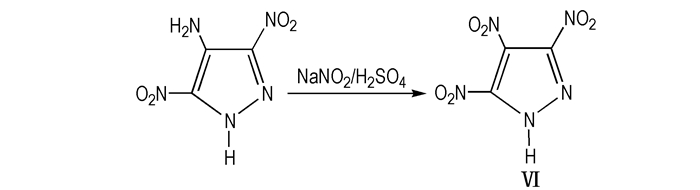
|
Scheme7 Diazotization route of TNP |
③ 用硝酸和发烟硫酸直接硝化3,5-二硝基吡唑而得到目标物Ⅵ。
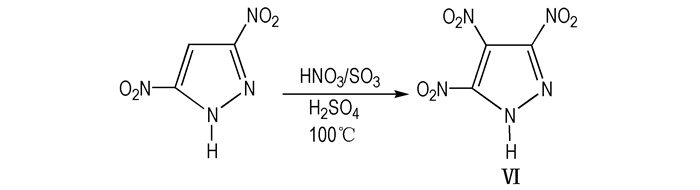
|
Scheme8 Direct nitration of 3,5-dinitropyrazole to give TNP |
上述三种线路中由4-氨基-3,5-二硝基吡唑经氧化形成目标物Ⅵ的产率可达93%(Scheme 6), 5-氨基-3,4-二硝基吡唑氧化形成目标物Ⅵ产率为37%(Scheme 7), 由4-氨基-3,5-二硝基吡唑经重氮化、硝化形成目标物Ⅵ的产率为80%(Scheme 8)。但是经氧化或重氮化过程都需要中间体3,5-二硝基吡唑的进一步反应, 步骤较多, 会使得目标物的最终收率降低。比较表明, 3,5-二硝基吡唑经发烟硫酸和硝酸直接硝化步骤较少, 产率可达94%(Scheme 8), 是目前合成目标物Ⅵ较优的方法。
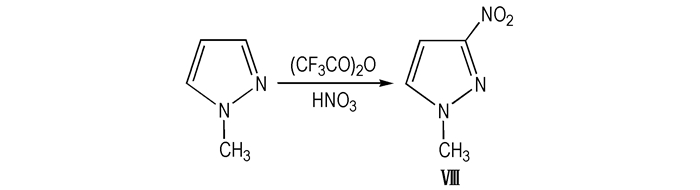
2.2 甲基硝基吡唑衍生物的合成及应用 2.2.1 1-甲基-3-硝基吡唑(Ⅷ)Ⅷ的熔点为80~83 ℃、爆速6.62 km·s-1、爆压17.11 GPa、密度1.47 g·cm-3[19], 目前对该化合物的研究报道尚不多。
Alan等[36]在冰浴条件下将N-甲基吡唑加入三氟醋酐中保温1 h, 冷却条件下, 将浓硝酸加入上述混合物中, 室温下搅拌12 h, 过量的三氟乙酸和硝酸真空下移去, 得硝化衍生物粗品, 柱色谱纯化得Ⅷ, 线路见Scheme 9。
|
Scheme9 Synthetic route of 1-methyl-3-nitropyrazole |
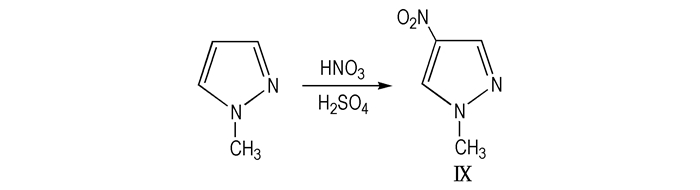
Ⅸ的熔点为92 ℃、密度1.40 g·cm-3、爆速6.42 km·s-1、爆压15.52 GPa[19], 可用作含能材料及其中间体。以1-甲基吡唑为原料, 硫酸和浓硝酸为硝化剂, 常温反应, 结束后将反应混合物倒入冰水, 析出白色固体物质, 过滤、干燥得Ⅸ(Scheme 10)。
|
Scheme10 Direct nitration of 1-methylpyrazole to give 1-methyl-4-nitropyrazole |
Ⅹ的熔点为20~23 ℃, 常温(25 ℃)下为液态, 爆速7.76 km·s-1、爆压25.57 GPa、密度1.67 g·cm-3[19], 300 ℃以下是热力学稳定状态。由于其熔点较低, 在常温下可作为一种液体单质炸药, 也可用作降低熔铸炸药熔点的液相载体物, 由于其热稳定性好, 能够提高高能炸药在低熔点含能物中的稳定性。
3,4-MDNP是典型的硝基吡唑类化合物, 新西兰奥塔哥大学化学部的Grimmett等[37]1978年, 用5倍量的发烟硝酸在80%硫酸中硝化1-甲基吡唑, 100 ℃条件下反应18 h, 合成得到3,4-MDNP, 测得其熔点为20 ℃, 但得率仅有20%;还尝试了将1-甲基-3-硝基吡唑在80%的硫酸和硝酸体系中硝化, 也得到化合物Ⅹ。2012年Ravi等[14]将蒙脱石K-10浸渍到硝酸铋的四氢呋喃悬溶液中, 硝化1-甲基吡唑得目标化合物Ⅹ; 常温下用该硝化体系硝化1-甲基-3-硝基吡唑得Ⅹ, 且提到此两种方法, 得率均在95%以上。
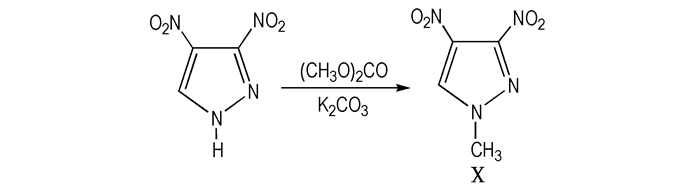
李永祥等[38]主要以3,4-二硝基吡唑为原料、碳酸二甲酯为甲基化试剂、无水碳酸钾为催化剂, 通过甲基化反应制备目标化合物3,4-MDNP(Scheme 11)。并优化了反应条件, 得到的最佳工艺条件为:反应温度90 ℃; 反应时间6.5 h; 3,4-二硝基吡唑、碳酸二甲酯与无水碳酸钾的摩尔比为1:10.6:1.5, 产品得率95.6%、纯度大于93.0%、熔点20 ℃。
|
Scheme11 Methylation of 3,4-DNP to give 3,4-MDNP |
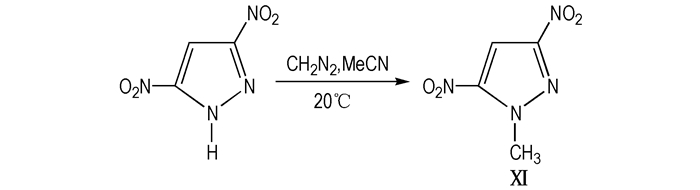
Ⅺ的熔点为60 ℃左右、密度为1.68 g·cm-3、爆速7.77 km·s-1、爆压25.65 GPa[19], 是高能量密度材料的候选物质之一。该物质的合成方法的报道不多, 2007年, Zaitsev等[39]以3,5-二硝基吡唑为原料, 重氮甲烷为甲基化试剂合成出1-甲基-3,5-二硝基吡唑, 线路如Scheme 12。该方法中使用的重氮甲烷是高毒性物质, 以后的合成研究中应该尝试符合绿色化研究方向的绿色甲基化试剂——碳酸二甲酯。
|
Scheme12 Synthetic route of 3,5-MDNP |
MTNP是一种淡黄色固体, 易溶于有机溶剂, 微溶于水, 爆速为8650 m·s-1(较TNT高出1800 m·s-1)、爆压33.7 GPa(较TNT高出13 GPa)、熔点91.5 ℃, 是一种高能钝感低熔点炸药[13]。
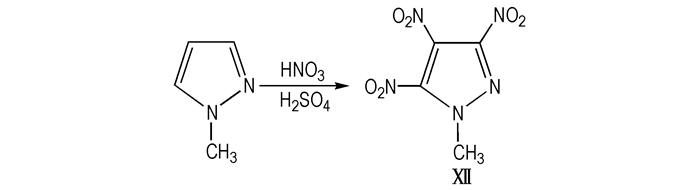
(1) Ravi[13-16]对MTNP进行了大量合成及性能研究, 具体方法:将98%的H2SO4在温度低于15 ℃条件下, 逐滴加入发烟硝酸中, 搅拌15 min后, 加入1-甲基吡唑, 升温至110 ℃, 反应结束后倒入碎冰中, 饱和NaHCO3中和, 乙酸乙酯反复萃取并合并有机层, 水和盐水洗涤, Na2SO4干燥, 蒸去液体得到浅黄色固体物质Ⅻ, 线路见Scheme 13。
|
Scheme13 Preparation of TNP via direct nitration by mixture of nitric acid and sulfuric acid[13] |
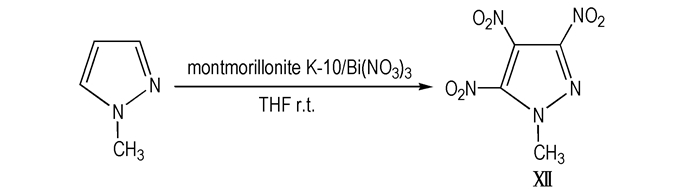
将1-甲基吡唑和蒙脱石K-10加入到浸渍在THF中的硝酸铋中, 搅拌反应, 结束后在真空泵下蒸去溶剂, 二氯甲烷反复洗涤, 浓缩得到Ⅻ的粗品(Scheme 14)。
|
Scheme14 Direct nitration of 1-methylpyrazole by impregnated bismuth nitrate[15] |
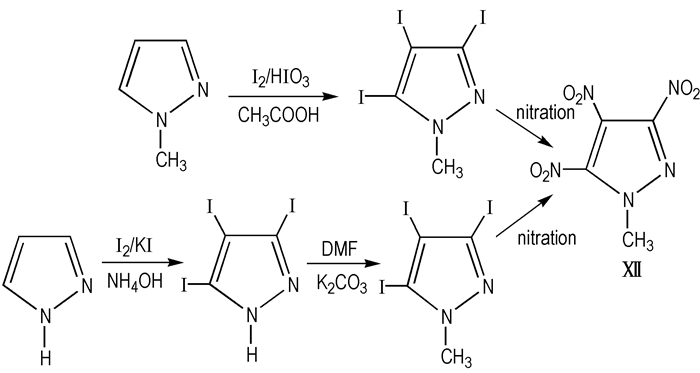
以甲基吡唑、碘及乙酸、碘酸及硫酸为原料, 反应得到三碘取代的产物, 硝酸中硝化得到目标物MTNP; 以吡唑、碘、碘化钾和氨水为原料反应得到3,4,5-三碘吡唑, 甲基化得到1-甲基-3,4,5-三碘吡唑, 硝酸的条件下的到目标物MTNP, 具体线路见Scheme 15。
|
Scheme15 Synthetic route of MTNP[14] |
Scheme 13路线中使用了传统的混酸硝化工艺, 该工艺会产生大量的含有机化合物的废酸和废水, 腐蚀性强, 污染环境, 治理费用高, 在寻求绿色发展的当今社会中, 该法不可取。Scheme 14中的蒙脱石或八面沸石, 是价格便宜、易得得绿色催化剂, 可减少污染物的排放, 降低能耗, 提高资源的利用率。硝酸铋是新型的硝化剂, 其反应结束后易处理, 避免了传统工艺的酸对仪器的腐蚀、同时还减少了反应的酸化产物, 反应条件还温和、易控制。Scheme 15中使用了价格较贵的碘和碘酸, 碘易升华, 且反应过程中能产生污染环境的废液, 这与绿色化学的研究方向相悖。
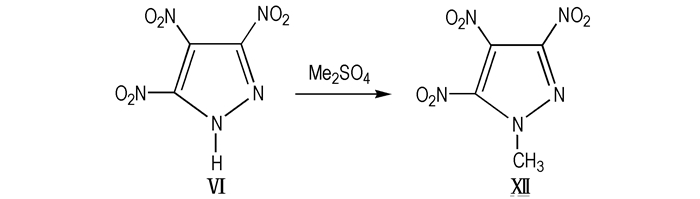
(2) Dalinger等[11]将TNP在NaHCO3水溶液的条件下用Me2SO4甲基化得到目标物Ⅻ(Scheme 16)。
|
Scheme16 Preparation of MTNP via methylation of TNP |
该法使用的原料TNP需要经过三步硝化来合成, 较为繁琐, 得率不高, 且Me2SO4有剧毒。因此, 寻找合成TNP的较优工艺及使用低毒的碳酸二甲酯和三氟甲磺酸甲酯来代替Me2SO4来做甲基化试剂显得尤为重要。
(3) 李雅津[17]借鉴了Scheme 15的线路, 在0~10 ℃恒温水浴下的冰乙酸中加入碘单质, 后将溶解有碘酸的硫酸溶液与1-甲基吡唑滴入上述混合物, 最后加入CCl4, 升温至80 ℃, 反应2.5 h, 倒入冰水浴中析出白色絮状物, 抽滤、饱和Na2SO4和盐水冲洗、烘干, 得1-甲基-3,4,5-三碘吡唑, 丙酮/水精制得到乳白色粉末状固体。1-甲基-3,4,5-三碘吡唑加到硝酸中加热回流1.5 h, 倒入冰水中, 碳酸氢钠中和, 乙醚反复萃取, Na2SO4干燥, 蒸去溶剂得浅黄色固体MTNP, 线路见Scheme 17。
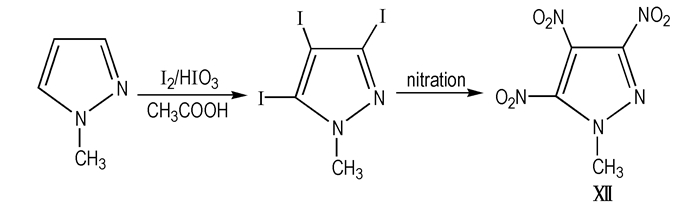
|
Scheme17 Iodization and nitration of 1-methylpyrazole to give MTNP |
该法将碘单质溶解于冰醋酸、将碘酸溶于硫酸, 再将两种溶液混合, 能使固体能很好地溶解于液相中, 反应易于控制, 反应完全。但是该法形成中间体1-甲基-3,4,5-三碘吡唑的过程, 会有污染环境的废液产生, 无法处理。还尝试了用硝硫混酸直接硝化N-甲基吡唑的方法, 对不同的反应温度、反应时间、加料比及加料顺序都进行了实验探索, 但结果均不理想, 未得到目标物MTNP。
MTNP的爆炸性能与RDX相当, 感度接近B炸药, 是一种新型不敏感高能单质炸药, 在很多的炸药配方中可以代替TNT, RDX和HMX, 是一种良好的可替代TNT作为熔铸炸药载体的潜在含能化合物[17]。国外已在Ⅻ的合成及热稳定性和化学稳定性[38]方面进行了大量的探索与研究, 然而国内还未形成成熟的合成路线, 因此加大对MTNP的研究将是我们以后研究的重点, 希望能为吡唑类含能材料的进一步研究提供一定的新思路。
部分硝基吡唑炸药与常见的炸药性能如表 1所示。
| 表 1 几种硝基吡唑炸药与常见炸药的性能比较[12-13, 20, 32] Tab.1 The performances of several nitropyrazoles and common explosives |
硝基吡唑衍生物表现出了较好的含能化合物的性能, 特别是MTNP与3,4-DNP的性能优良, 它们的爆速比TNT分别高出1800 m·s-1和1100 m·s-1、爆压分别高出13 GPa和8 GPa, 综合能量有较大提高, 是潜在的熔铸炸药载体。因此该类化合物为熔铸炸药配方载体的选择提供了一定参考。
(1) MTNP为甲基吡唑的三位硝化产物, 其合成在国内尚处于探索阶段, 寻找新的合成线路并优化其工艺将会是以后的研究重点。
(2) 3,4-DNP与MTNP作为优良的熔铸炸药载体, 是能够替代TNT的较具潜力的候选物质, 其物化性能的研究及与其它高能化合物的组合配方(如与RDX或HMX等的混合)将会成为以后含能化合物的研究热点。
(3) 硝基吡唑化合物的合成一般采用传统的硝化剂, 不符合当代绿色化学的要求, 进一步寻找符合条件的绿色硝化剂和催化剂在未来的硝化工艺中显得尤为重要。
| [1] |
安守忠.
含氮有机化合物概论[M]. 北京: 科学出版社, 1983.
AN Shou-zhong. Overview of nitrogenous organic compounds[M]. Beijing: Science press, 1983 |
| [2] |
徐松林, 阳世清, 岳守体. 偶氮四唑类高氮含能化合物的合成及表征[J].
火炸药学报, 2005, 28(3): 52-54. XU Song-lin, YANG Shi-qing, YUE Shou-ti. The synthesis and characterization of azo tetrazole high nitrogen compounds[J]. Chinese Journal of Explosives & Propellants, 2005, 28(3): 52-54. |
| [3] |
阳世清, 徐松林, 雷永鹏. 氮杂环含能化合物的研究进展[J].
含能材料, 2006, 14(6): 475-484. YANG Shi-qing, XU Song-lin, LEI Yong-peng. The research progress of nitrogen heterocyclic compounds[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(6): 475-484. |
| [4] |
Boiani M, González M. Imidazole and benzimidazole derivatives as chemotherapeutic agents[J].
Mini Rev Med Chem, 2005, 5(4): 409-424. DOI:10.2174/1389557053544047 |
| [5] |
白雪, 周成合, 米佳丽. 三唑类化合物研究与应用[J].
化学研究与应用, 2007, 19(7): 721-729. BAI Xue, ZHOU Cheng-he, MI Jia-li. Research and application of triazoles[J]. Chemical Research and Apphcafion, 2007, 19(7): 721-729. |
| [6] |
Knölker H J, Reddy K R. Isolation and synthesis of biologically active carbazole alkaloids[J].
Chem Rev, 2002, 102(11): 4303-4427. DOI:10.1021/cr020059j |
| [7] |
孔繁玲. 硝基吡唑铜盐的合成与应用研究[J].
兵工学报, 1996(2): 52 KONG Fan-ling. The synthesis and applied research of nitropyrazole copper salt[J]. Acta Armamentarii, 1996(2): 52 |
| [8] |
李翠屏, 孙天旭, 陈新志. 3-硝基吡唑的合成[J].
染料与染色, 2004, 41(3): 168-169. LI Cui-ping, SUN Tian-xu, CHEN Xin-zhi. Synthesis of 3-nitropyrazole[J]. Dyestuffs and Coloration, 2004, 41(3): 168-169. |
| [9] |
李洪丽, 熊彬, 姜俊, 等. 3-硝基吡唑及其盐类的合成与表征[J].
火炸药学报, 2007, 31(2): 102-108. LI Hong-li, XIONG Bin, JIANG Jun, et al. Synethsis and characterization of 3-nitropyrazole and its salts[J]. Chinese Journal of Explosives & Propellants, 2007, 31(2): 102-108. |
| [10] |
Dalinger I L, Popova G P, Vatsadze I A, et al. Synthesis of 3,4,5-trinitropyrazole[J].
Russ Chem Bul, 2009, 58(10): 2185 DOI:10.1007/s11172-009-0301-2 |
| [11] |
Dalinger I L, Vatsadze I A, Shkineva T K, et al. The specific reactivity of 3,4,5-trinitro-1H-pyrazole[J].
Mendeleev Commun, 2010, 20(5): 253-254. DOI:10.1016/j.mencom.2010.09.003 |
| [12] |
Herve G, Roussel C, Graindorge H. Selective preparation of 3,4,5-trinitro-1H-pyrazole: A stable all-carbon-nitrated arene[J].
Angew Chem Int Ed, 2010, 49: 3177-3181. DOI:10.1002/anie.v49:18 |
| [13] |
Ravi P, Girish G M, Sikder A K, et al. Thermal decomposition kinetics of 1-Methyl-3,4,5-trinitropyrazole[J].
Thermochimica Acta, 2012, 528: 53-57. DOI:10.1016/j.tca.2011.11.001 |
| [14] |
Ravi P, Koti R C, Saikia A, et al. Nitrodeiodination of polyiodopyrazoles[J].
Propellants Explosive Pyrotech, 2012, 37: 167-171. DOI:10.1002/prep.v37.2 |
| [15] |
Ravi P, Tewari S P. Facil and environmentally friendly synthesis of nitropyrazoles using montmorillonite K-10 impregnated with bismuth nitrate[J].
Catalysis Communications, 2012, 19: 37-41. DOI:10.1016/j.catcom.2011.12.016 |
| [16] |
Ravi P, Tewari S P. Faujasite catalyzed nitrodeiodination of iodopyrazoles[J].
Catalysis Communications, 2013, 42: 35-39. DOI:10.1016/j.catcom.2013.07.032 |
| [17] |
李雅津, 曹端林, 杜耀, 等. 1-甲基-3,4,5-三硝基吡唑的合成与表征[J].
火炸药学报, 2013, 36(3): 28-30. LI Ya-jin, CAO Duan-lin, DU Yao, et al. Synthesis and characterization of 1-methyl-3,4,5-trinitropyrazoles[J]. Chinese Journal of Explosives & Propellants, 2013, 36(3): 28-30. |
| [18] |
LI Ya-jin, LI Yong-xiang, WANG Yan-hong, et al. Theoretical calculation of the detonation parameters of nitropyrazoles explosives[J].
Advanced Materials Research, 2014, 853: 395-400. |
| [19] |
仪建红, 胡双启, 刘胜楠, 等. 硝基吡唑类衍生物的结构和爆轰性能的理论研究[J].
含能材料, 2010, 18(3): 252-256. YI Jian-hong, HU Shuang-qi, LIU Sheng-nan, et al. Theoretical study on structures and detonation performances for nitro derivatives of pyrazole by density functional theory[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2010, 18(3): 252-256. |
| [20] |
Janssen J, Habrake C L. Pyrazoles. Ⅷ. Rearrangement of N-nitropyrazoles. The formation of 3-nitropyrazole[J].
J Org Chem, 1971, 21(36): 3081-3084. |
| [21] |
Kanishchev M I, Korneeva N V, Shevelev S A, et al.
Nitropyrazoles(Review)[M]. Plenum Publishing Corporation, 1988: 435-453. |
| [22] |
Rao E N, Ravi P, Tewari S P. Experimental and theoretical studies on the structure and vibrational properties of nitropyrazoles[J].
Journal of Molecular Structure, 2013(1043): 121-131. |
| [23] |
Jadhav H S, Talawar M B, Sivabalan B, et al. Synthesis, characterization and thermolysis studies on new derivatives of 2, 4, 5-trinitroimidazoles: Potential insensitive high energy materials[J].
Journal of Hazardous Materials, 2007, 143: 192-197. DOI:10.1016/j.jhazmat.2006.09.014 |
| [24] |
汪营磊, 姬月萍, 陈斌, 等. 3,4-二硝基吡唑合成与性能研究[J].
含能材料, 2011, 19(4): 377-379. WANG Ying-lei, JI Yue-ping, CHEN Bin, et al. Improved synthesis of 3,4-dinitropyrazole[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2011, 19(4): 377-379. |
| [25] |
蒋秋黎, 王浩, 罗一鸣, 等. 3,4-二硝基吡唑的热行为及其与某些炸药组分的相容性[J].
含能材料, 2013, 21(3): 297-300. JIANG Qiu-li, WANG Hao, LUO Yi-ming, et al. Thermal behaviors of 3,4-dinitrophyrazoIe and its compatibility with some explosive component materials[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2013, 21(3): 297-300. |
| [26] |
田新. 3,4-二硝基吡唑合成及性能研究[D]. 北京: 中国工程物理研究院. 2012.
TIAN Xin. Improved synthesis of 3,4-dinitropyrazole[D]. Beijing: China Academy of Engineering Physic. 2012. |
| [27] |
田新, 李金山. 3,4-二硝基吡唑热分解及非等温动力学[J].
化学研究与应用, 2013, 25(2): 206-209. TIAN Xin, LI Jin-shan. Thermal decomposition and non-isothermal kinetics of 3,4-dinitropyrazole[J]. Chemical Research and Application, 2013, 25(2): 206-209. |
| [28] |
杜闪. 3,4-二硝基吡唑的合成及其性能研究[D]. 太原: 中北大学. 2012.
DU Shan. Synthesis and properties of 3,4-dinitropyrazole[D]. Taiyuan: North University of China. 2012. |
| [29] |
李永祥, 曹端林, 王建龙. 三种新型低熔点炸药的合成及表征[J].
兵工学报, 2013, 34(1): 36-40. LI Yong-xiang, CAO Duan-lin, WANG Jian-long. Synthesis and characterization studies on novel three explosives with low melting pointp[J]. Journal of China Ordnance, 2013, 34(1): 36-40. |
| [30] |
杜闪, 李永祥, 王建龙, 等. 3,4-二硝基吡唑合成方法及性能研究综述[J].
化学研究, 2011, 22(5): 106-110. DU Shan, LI Yong-xiang, WANG Jian-long, et al. Review for synthetic method and properties of 3,4-dinitropyrazole[J]. Chemical Research, 2011, 22(5): 106-110. |
| [31] |
曹端林, 李雅津, 杜耀, 等. 熔铸炸药载体的研究评述[J].
含能材料, 2013, 21(2): 157-165. CAO Duan-lin, LI Ya-jin, DU Yao, et al. ReviewonCarriers for Melt-cast Explosives[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2013, 21(2): 157-165. |
| [32] |
Lebedev V P, Matyushim Y N, Inolemtcev Y D. Thermochemical and explosive properties of nitropyrazoles[C]//29th Fraunhofer-Institut fur Chemische Technologie, 1998, 180.
|
| [33] |
Janssen J, Koeners H J, Kruse C G, et al. Pyrazoles. Ⅻ. The preparation of 3(5)-nitropyrazoles by thermal rearrangement of N-nitropyrazoles[J].
J Org Chem, 1973, 38(10): 1777-1782. DOI:10.1021/jo00950a001 |
| [34] |
汪营磊, 张志忠, 王伯周, 等. 3,5-二硝基吡唑合成研究[J].
含能材料, 2007, 15(6): 574-576. WANG Ying-lei, ZHANG Zhi-zhong, WANG Bo-zhou, et al. Synthesis of 3,5-Dinitropyrazole[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2007, 15(6): 574-576. |
| [35] |
成健. 不同硝化体系中3,5-二硝基吡唑的合成[D]. 南京: 南京理工大学, 2007.
CHEN Jian. Synthesis of 3,5-Dinitropyrazole under different nitrification system[D]. Nanjing: Nanjing University of Science and Technology. 2007. |
| [36] |
Katritzky A R, Scriven E F V, Majumder S, et al. Direct nitration of five membered heterocycles[J].
ARKIVOC, 2005(iii): 179-191. |
| [37] |
Katritzky A R.
Physical methods in heterocyelic chemistry[M]. New York: Academic Press, 1974 |
| [38] |
李永祥, 曹端林, 王建龙, 等. 一种1-甲基-3,4-二硝基吡唑的制备方法: CN103467381A[P], 2013.
LI Yong-xiang, CAO Duan-lin, WANG Jian-long, et al. A preparation method of 1-methyl-3,4-dinitropyrazole: CN103467381A[P], 2013. |
| [39] |
Zaitsev A A, Dalinger I L. Dinitropyrazoles[J].
Russion Chemical Reviews, 2009, 78(7): 589-627. DOI:10.1070/RC2009v078n07ABEH004015 |
| [40] |
Dalinger I L, Shevelev S, Korolev V, et al. Chemistry and thermal decomposition of trinitropyrazoles[J].
J Therm Anal Calorim, 2011, 105: 509-516. DOI:10.1007/s10973-010-1213-y |
Synthesis of the 12 kinds of nitropyrazoles were summarized and compared in detail, and their development is prospected.




