2. 西南科技大学, 四川 绵阳 621010
2. Southwest University of Science and Technology, Mianyang 621010, China
飞行器动力源是航空航天技术的基础研究领域, 动力源的大小直接关系到飞行器航程、航速及载荷, 随着航空航天技术的不断发展, 各种飞行器(例如导弹、飞机)的速度和航程都在不断提高, 这对其所用燃料的密度和燃烧热值提出更高的要求[1-4]。一般情况下, 在飞行器燃料箱容积有限的情况下, 燃料密度越大所携带的燃料质量越多[5], 燃烧热值越高则单位体积的燃料所携带的能量越大。
自20世纪80年代以来, 世界各国除了致力于已有高密度烃类燃料的改性及应用外, 开始研制密度大于1.0 g·cm-3、能量更高的烃类燃料, 其中高张力笼状烃类化合物的研究是热点之一[6-8]。这类化合物不仅具有较大的密度(一般大于1.0 g·cm-3)和较高的碳氢比[9], 同时由于在合成过程中通过拉紧C—H键角至90°或60°, 使化合物具有立方体或四面体的结构, 从而向化合物中引入张力能量, 使其具有更高的燃烧热值[8], 在这类分子中一旦某一个键被打破, 整个分子就很快破碎而释放出很高的能量。这类化合物主要有立方烷、高立方烷、棱柱烷、三环[2.1.1.05,6]己烷、四环[2.2.1.02,6.03,5]庚烷和五环[5.4.0.02,6.03,10.05,9]十一烷烯烃等[10], 它们具有比JP-10、RJ-4更高的燃烧热值。
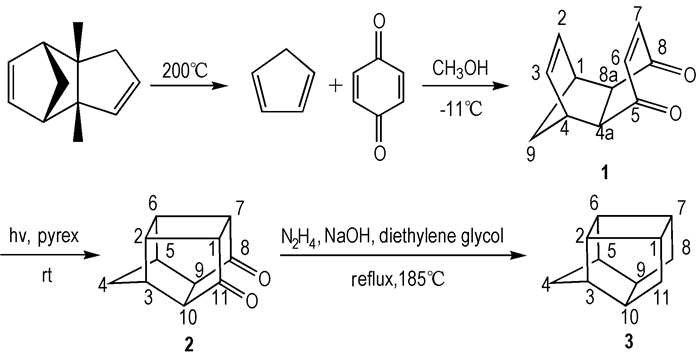
五环[5.4.0.02,6.03,10.05,9]十一烷作为一种新型高密度笼状烃燃料, 其燃烧热值高达51.66 MJ·L-1, 比当今大量使用的液体高密度燃料JP-10的热值要高12 MJ·L-1。目前, 关于五环[5.4.0.02,6.03,10.05,9]十一烷的合成研究报道较少。Stedman R J等[11] 1970年报道了一种运用六步反应合成五环[5.4.0.02,6.03,10.05,9]十一烷的方法, 该方法总产率仅为14%。1974年Marchand等[12]用环戊二烯和对苯二醌为原料, 经过Diels-Alder加成、[2+2]环加成和黄鸣龙还原反应合成出五环[5.4.0.02,6.03,10.05,9]十一烷, 总产率47%, 但是该方法存在以下不足: Diels-Alder加成反应过程中滴加环戊二烯时溶液温度需在-70 ℃以下, 条件苛刻, 不易达到; [2+2]环加成反应合成的产物在乙酸乙酯中溶解性差, 易在光反应仪器壁上结焦, 影响了光的通透性, 不利于反应进行, 且文献未介绍产物的提纯方法; 黄鸣龙还原反应后处理过程中所用溶剂四氯化碳和溴的毒性很大, 且分离过程需要用层析住, 不适合大规模生产应用。针对以上不足, 本研究对该方法进行了改进, 将Diels-Alder加成反应过程中滴加环戊二烯时溶液温度由-70 ℃提高至-11 ℃, [2+2]环加成反应采用对产物溶解性良好且能吸收紫外光的丙酮做溶剂, 避免了使用易使产物在Pyrex管壁上结焦的溶剂乙酸乙酯, 黄鸣龙还原反应的产物提纯运用了水蒸气蒸馏法, 避免了使用强毒性的四氯化碳, 且不需要通过层析柱分离, 并对Diels-Alder加成和[2+2]环加成反应的反应条件进行了优化。通过改进Marchand等人的合成方法, 不仅提高了反应收率、简化了操作过程, 且降低了成本, 为五环[5.4.0.02,6.03,10.05,9]十一烷的规模化合成奠定了基础。
2 实验部分 2.1 试剂与仪器试剂:二聚环戊二烯、对苯二醌、甲醇、甲苯、石油醚、二乙二醇、无水硫酸钠、氢氧化钠、二氯甲烷和丙酮等均为分析纯(成都市科龙化工试剂厂), 无水肼(分析纯, 99%, 湖北鑫润德化工有限公司)。
仪器: Büchi B-545熔点仪(温度未校正); 开封市宏兴科教仪器厂OCRS-I型500W光化学反应仪; Bruker核磁共振仪(AV Ⅱ-300MHz、400 MHz、600 MHz; TMS为内标); 美国PE仪器公司Spectrum One型傅里叶变换红外光谱仪; Finnigan TSQ Quantum Ultr质谱仪; 美国Thermo公司DSQ Ⅱ质谱仪(EI源); 美国Thermo公司MAT95XP高分辨质谱仪(EI源); Dionex公司P680A高效液相色谱仪。
2.2 合成路线
|
Scheme1 |
将二聚环戊二烯加入单口烧瓶中, 烧瓶上连接刺形冷凝柱, 冷凝柱上连接温度计和冷凝管, 将二聚环戊二烯加热至200 ℃左右使其裂解, 收集36~42 ℃的馏分, 接收瓶用冰水冷却, 该馏分即环戊二烯。
2.3.2 1,4,4a,8a-四氢-1,4-桥亚甲基萘-5,8-二酮(1)的合成在100 mL圆底烧瓶中, 加入12.5 g(112.5 mmol)对苯二醌和20 mL甲醇, 用-11 ℃冰盐浴冷却, 机械搅拌, 将新制备的7.45 g(113.5 mmol)环戊二烯与5 mL甲醇的混合溶液逐滴加入烧瓶中, 滴加完成后撤去冰盐浴, 室温机械搅拌约3 h反应结束, 将反应液真空浓缩得土黄色固体产物。用石油醚(沸程60~90 ℃)重结晶, 得浅黄色晶体产物19.01 g, 收率95.3%, m.p. 75.0~76.5 ℃(文献值[12]为76.0~78.5 ℃); 1H NMR(CDCl3, 300MHz) δ: 1.41(d, J=8.73Hz, 1H, 9a-H), 1.52(d, J=8.73 Hz, 1H, 9b-H), 3.20(s, 2H, 4a, 8a-H), 3.53(s, 2H, 1, 4-H), 6.05(s, 2H, 2, 3-H), 6.55(s, 2H, 6, 7-H); 13C NMR(CDCl3, 75 MHz) δ: 48.20, 48.57, 48.62, 135.16(2, 3-C), 141.92(6, 7-C), 199.32(C=O); IR(KB, ν /cm-1): 3426, 3032(C=C), 2987, 1668(C=O), 1387, 1335(—CH), 1299, 1140, 1066, 873; MS(ESI) m/z: 197.1(M+Na)+。
2.3.3 五环[5.4.0.02,6.03,10.05,9]十一烷-8,11-二酮(2)的合成中压汞灯置于石英玻璃冷肼中, 将Pyrex管套在冷肼上, 使透过Pyrex管照在反应器上的光的波长集中在290~375 nm之间, 将12.00 g(68.9 mmol)化合物1溶解于750 mL的丙酮中, 置于光反应器内, 中压汞灯距溶液距离18mm, 打开500W中压汞灯照射光反应器, 室温搅拌下照射反应液23 h, 将光照后的反应液真空浓缩, 用甲苯-石油醚重结晶得白色固体, 干燥后得产物10.80 g, 收率90.0%, m.p. 240.5~241.0 ℃(文献[12]为243.0~243.5 ℃), 1H NMR(CDCl3, 400 MHz) δ: 1.90(d, J=11.6 Hz, 1H, 4a-H), 2.05(d, J=11.6 Hz, 1H, 4b-H), 2.71(s, 2H, 9, 10-H), 2.81(t, J=2.4 Hz, 2H, 1, 7-H), 2.95(dd, J=3.2, 1.6 Hz, 2H, 3, 5-H), 3.19(d, J=1.6 Hz, 2H, 2, 6-H); 13C NMR(CDCl3, 100MHz) δ: 38.61(2, 6-C), 40.37(4-C), 43.69(1, 7-C), 44.53(3, 5-C), 54.63(9, 10-C), 212.21(8, 11-C); IR(KBr, ν/cm-1): 3444, 2992, 2931(—CH2), 1754(C=O), 1190, 1059; MS(ESI) m/z: 196.94(M+Na)+。
2.3.4 五环[5.4.0.02,6.03,10.05,9]十一烷(3)的合成将2.00 g化合物2、4 mL无水肼和1.00 g氢氧化钠加入55 mL的二乙二醇中, 在180 ℃左右加热3.5 h, 之后用水蒸气蒸馏, 用二氯甲烷萃取水相, 用无水硫酸钠干燥, 过滤, 真空浓缩得1.01 g产物, 收率60.2%, m.p. 200.3~201.5 ℃(文献[12]为204.0~204.5 ℃), HPLC测定质量分数大于98%; 1H NMR(CDCl3, 600 MHz) δ: 0.97(d, J=11.94Hz, 2H, 8a, 11a-H), 1.17(d, J=10.08Hz, 1H, 4a-H), 1.44(d, J=12.06, 2H, 8b, 11b-H), 1.63(d, J=10.08Hz, 1H, 4b-H), 2.14(s, 2H, 9, 10-H), 2.22(s, 2H, 2, 6-H), 2.53(s, 4H, 1, 3, 5, 7-H); 13C NMR(CDCl3, 150 MHz) δ: 27.04(8, 11-C), 33.71(4-C), 36.17(1, 7-C), 42.10(9, 10-C), 43.54(2, 6-C), 46.52(3, 5-C); IR(KBr, ν/cm-1): 3410, 2954, 2861(—CH2), 1633, 1467, 1321(—CH), 1126, 1060; MS(EI) m/z (%): 146.05(M+, 22.92), 131.05(8.52), 117.00(24.40), 104.00(10.47), 91.00(15.90), 80.00(100.00), 66.00(34.74), 39.00(7.44); HRMS(EI) calcd for C11H14 146.1095, found 146.1088。
3 结果与讨论 3.1 化合物1收率的影响因素 3.1.1 滴加环戊二烯时溶液温度对反应的影响环戊二烯与对苯二醌在物质的量比为1:1时, 反应时间为3 h, 二者通过Diels-Alder加成反应生成化合物1。表 1为滴加环戊二烯时溶液温度对化合物1收率的影响, 由表 1可见, 滴加环戊二烯时溶液温度低于-11 ℃时, 收率随温度升高而增大, 而当温度高于-11 ℃时, 继续升温会使收率降低。分析认为, 这主要是因为反应温度过低时, 对苯二醌和环戊二烯反应速率慢, 随着温度逐渐升高, 反应速度加快; 但反应温度过高(>-11 ℃)时, 副反应逐渐增多, 环戊二烯易发生聚合, 致使目标产物的收率降低,因此,-11 ℃被认为是最优温度。
| 表 1 滴加环戊二烯时溶液温度对化合物1收率的影响 Tab.1 Effect of solution temperature on the yield of compound 1 when dropping cyclopentadiene |
环戊二烯与对苯二醌在物质的量比为1:1时, 滴加环戊二烯时溶液温度-11 ℃, 常温机械搅拌时考察反应时间对产物收率的影响, 实验结果见表 2。由表 2可见, 反应时间由1 h增加到3 h, 收率由75.2%逐渐增加到95.3%, 若继续延长反应时间, 产物收率没有明显提高, 即最佳反应时间为3 h, 此时收率比文献[12]高2.3%。由于产物1在甲醇中溶解性低, 反应体系易由液体变成半液半固体的非均匀体系, 从而使溶液内分子间的有效碰撞减小, 影响了反应收率, 所以采用机械搅拌可以避免液体变成半液半固体, 提高反应收率。
| 表 2 反应时间对化合物1收率的影响 Tab.2 Effect of reaction time on the yield of compound 1 |
将套着Pyrex管的中压汞灯置于光反应器中, 首先测试原料浓度变化对收率的影响。在反应过程中, 以丙酮做溶剂, 光照时间23 h, 随着光照时间的增加, Pyrex管壁上形成一层黄色薄膜, 出现结焦现象, 影响Pyrex管的透光性, 使反应体系接收光辐射能力降低。表 3为原料浓度对化合物2收率的影响。由表 3可以看出, 原料浓度直接影响反应速率和收率, 原料浓度增加, 收率逐渐降低, 这是因为原料浓度增加易在Pyrex管壁上结焦, 影响光的通透性, 不利于反应进行。且由于丙酮具有较小的单重激发态和三重激发态, 吸收紫外光的能量后通过系间跃迁可形成三重激发态, 并将能量传递给化合物1分子, 从而促进反应的进行, 原料浓度增加使三重激发态的丙酮与化合物1分子碰撞几率减小, 自淬灭几率增大, 能量传递减小, 反应收率降低, 实验发现2 g·125mL-1含量的反应体系是较佳选择。
| 表 3 原料浓度对化合物2收率的影响 Tab.3 Effect of raw materials concentration on the yield of compound 2 |
光照时间是影响化合物1分子内[2+2]环加成反应的重要因素, 在以丙酮做溶剂, 原料浓度为2 g·125mL-1的条件下, 光照时间与化合物2收率的关系如表 4所示。由表 4可见, 随着光照时间的延长, 收率逐渐增加, 光照时间超过23 h后收率增加不是很明显, 反应以光照时间23 h适宜。
| 表 4 光照时间与化合物2收率的影响 Tab.4 Effect of irradiation time on the yield of compound 2 |
分子内[2+2]环加成反应中, 化合物1的分子单重激发态和三重激发态能隙较大, 吸收光能后不易跃迁至三重激发态而发生化学反应, 因此要寻找更为有效的溶剂来激发反应。本研究选取了丙酮、50%丙酮-乙酸乙酯、乙酸乙酯、乙醇作为分子内[2+2]环加成反应的溶剂, 原料浓度为2 g·125mL-1, 光照时间23 h, 探讨溶剂对收率的影响, 其结果见表 5, 由表 5可见, 以丙酮作为溶剂的条件下收率最高, 可达90.0%, 比文献[12]收率高2.3%。这主要是因为丙酮能吸收波长为336 nm附近的紫外光后窜跃至单重激发态, 单重激发态吸收波长为367 nm附近的紫外光后窜跃至三重激发态, 并将能量传递给化合物1的分子, 促进化合物1的分子由单重激发态跃迁至三重激发态, 从而促进反应进行。而乙醇和乙酸乙酯对波长在290~375 nm的紫外光的吸收几乎为零, 且乙酸乙酯对化合物2溶解性差, 化合物2易在Pyrex管壁上结焦, 影响光的通透性, 所以选用乙醇和乙酸乙酯做溶剂时, [2+2]环加成反应收率较低。
| 表 5 溶剂对化合物2收率的影响 Tab.5 Effect of solvent on the yield of compound 2 |
以二聚环戊二烯在200 ℃裂解得到的环戊二烯为原料, 与对苯二醌发生Diels-Alder加成反应, 再经[2+2]环加成和黄鸣龙还原反应合成出五环[5.4.0.02,6.03,10.05,9]十一烷, 并对其合成工艺进行了优化, 该合成过程的最佳反应条件: Diels-Alder加成反应中, 滴加环戊二烯时溶液温度为-11 ℃, 反应时间3 h, 收率可达95.3%, 且滴加环戊二烯时溶液温度由-70 ℃提高至-11 ℃; [2+2]光环化反应中, 以丙酮为溶剂, 原料浓度为2 g·125mL-1, 光照时间为23 h时, 收率可达90.0%。黄鸣龙还原反应后处理过程中, 采用水蒸气蒸馏法分离提纯目标化合物, 与文献[12]相比, 避免了使用强毒性的四氯化碳, 且不需要经过层析住分离提纯, 简化了操作过程, 收率也由文献[12]的59%提高至60.2%。三步反应总收率由文献[12]的47.0%提高至51.6%, 且目标化合物纯度大于98%。本合成方法的优点是:工艺条件温和, 操作简单, 成本低, 适合于放大生产。
| [1] |
邢恩会, 米镇涛, 张香文. 用作新型高密度燃料的高张力笼状烃的研究进展[J].
火炸药学报, 2004, 27(2): 13-16. XING En-hui, MI Zhen-tao, ZHANG Xiang-wen. Development of high strained caged hydrocarbons as high densityfuels[J]. Chinese Journal of Explosive & Propellants, 2004, 27(2): 13-16. |
| [2] |
Burdette G W, Lander H R, Mcloy J R. High energy fuels for cruise missile[J].
Journal of Energy, 1978, 2(5): 289 DOI:10.2514/3.62381 |
| [3] |
李春迎, 杜咏梅, 何飞, 等. 高密度烃类化合物的合成[J].
化学通报, 2006, 69(2): w020 LI Chun-ying, DU Yong-mei, HE Fei, et al. Preparation of high density hydrocarbon compound[J]. Chemistry, 2006, 69(2): w020 |
| [4] |
Kubota N. Survey of rocket propellants and their combustion characteristics[J].
Fundamentals of Solid-Propellant Combustion, 1984, 90: 48-52. |
| [5] |
邹吉军, 张香文, 王莅, 等. 高密度液体碳氢燃料合成及应用进展[J].
含能材料, 2007, 15(4): 411-415. ZOU Ji-Jun, ZHANG Xiang-wen, WANG Li, et al. Progress on the synthesis and application of high-density liquid hydrocarbon fuels[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2007, 15(4): 411-415. |
| [6] |
李俊贤. 化学推进剂用精细化学品发展概况[J].
化学推进剂与高分子材料, 2003, 19(1): 3-4. LI Jun-xian. The developments of fine chemicals for chemical propellants[J]. Chemical propellants & Polymeric Materials, 2003, 19(1): 3-4. |
| [7] |
Chung H S, Chen C S H, Kremer R A, et al. Recent development in high-energy density liquid hydrocarbon fuels[J].
Energy & Fuels, 1999, 13(3): 641-649. |
| [8] |
Chen C S H, Schramm S E, Wentzek S E. Oxidatively stable esters derived from diamondoids totally hydroxylated at the Bridge-heads: US, 5397488[P], 1995.
|
| [9] |
Marchand A P, Deshpande M N, Reddy G M. Novel C22H24 alkene dimmers formed via titantium-promoted reductive dimerization of polycyclic cage ketones. Potential new fuels for airbreathing missiles[J].
American Chemical Society Division of Fuel Chemistry, 1989, 34(946): 954 |
| [10] |
张香文, 米镇涛, 李家玲. 巡航导弹用高密度烃类燃料[J].
火炸药学报, 1999, 22(4): 41-45. ZHANG Xiang-wen, MI Zhen-tao, LI Jia-ling. High density hydrocarbon fuels for cruise missile[J]. Chinese Journal of Explosive & Propellants, 1999, 22(4): 41-45. |
| [11] |
Stedman R J, Miller L S, Davis L D, Hoover J R E. Synthetic studies related to the bird-caged system.Ⅲ. derivatives of pentacyclo[5.4.0.02,6.03,10.05,9]undecane, Tetracyclo[4.4.0.03, 9.04, 8]decane, and pentacyclo[4.4.0.02, 5.03, 9.04, 8]decane[J].
Journal of Organic Chemistry, 1970, 35(12): 4169-4175. DOI:10.1021/jo00837a007 |
| [12] |
Marchand A P, Allen R W. An improved synthesis of pentacyclo[5.4.0.02,6.03,10.05,9]undecane[J].
Journal of Organic Chemistry, 1974, 39: 1596 |
Pentacyclo[5.4.0.02,6.03,10.05,9]undecane have been prepared in high yield by using cyclopentadiene and 1, 4-benzoquinone as starting materials.




