叠氮聚醚类含能增塑剂(GAPA)是含有烷基叠氮基团的端叠氮脂肪族聚醚含能增塑剂, 因其具有生成热高、密度大、燃气无腐蚀性、氮含量高、改善能量释放特性等优点[1], 主要用于火箭推进剂、烟火剂和高聚物黏结炸药(PBX)中。为了更好地研究GAPA推进剂性能, 需要对GAPA在温度升高时的热分解反应历程有一个较为清楚的认识, 目前国内外应用多种方法进行了广泛的实验及理论计算研究[2-4]。王刚[5]等采用TG/DSC-IR-MS联用技术对GAPA及其增塑聚P(BAMO/AMMO)的热分解特性进行研究, GAPA、GAPA/ P(BAMO/AMMO)的热分解主要经历两个阶段, 即叠氮基团的分解和聚醚主链的分解, GAPA可以降低P(BAMO/AMMO)的分解温度, 并且能提高体系表观分解热。徐若千[6]等合成了三臂型叠氮含能增塑剂GAPA, 并采用DSC和TG对GAPA进行了热分解研究, 表明GAPA是一种性能优良的齐聚物含能增塑剂。但是有关GAPA的热分解动力学过程尚未见报道。为此, 本研究采用TG-DSC联用技术对GAPA热分解规律进行了研究, 并在此基础上研究了GAPA热分解特性、机理函数、动力学方程、热力学参数和热安定性参数, 为深入研究GAPA推进剂热安定性和高温下燃烧性能奠定了基础。
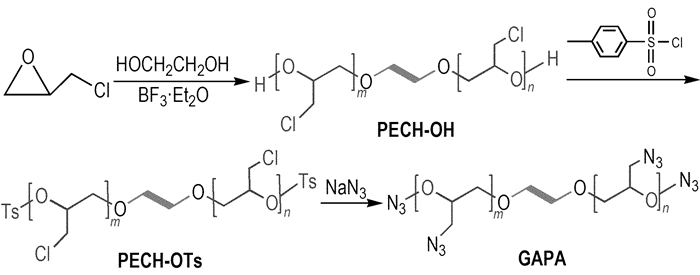
2 实验部分 2.1 样品的制备GAPA为实验室自制样品, 其制备方法如图 1所示。采用三步合成法, 以乙二醇为起始剂, 三氟化硼为催化剂, 环氧氯丙烷为单体进行聚合反应, 合成出高分子聚合物(PECH-OH), 经磺酸酯化、叠氮化后合成出端叠氮聚叠氮缩水甘油醚(GAPA)[7]。GAPA为淡黄色粘性液体, 数均分子量810(GPC), 羟值2.95 mgKOH·g-1, 纯度97.8%, 密度1.27 g·cm-3, 水分0.04%。元素分析(C23H39N24O2, %):理论值(实测值)C 34.33(35.06), H 4.8(4.89), N 41.79(46.15)。
|
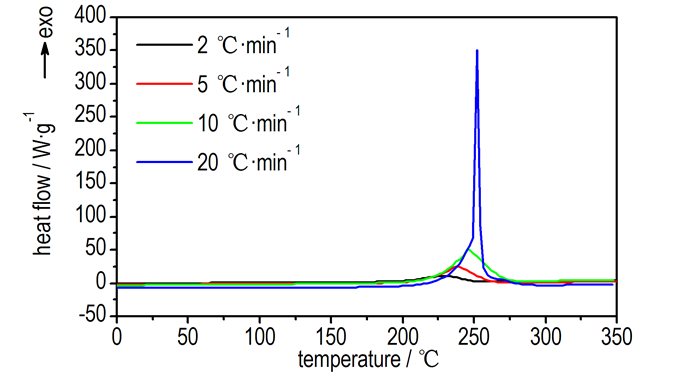
图 1 不同升温速率下GAPA的DSC曲线 Fig.1 DSC curves of GAPA at different heating rates |
|
Scheme 1 Synthetic route of GAPA[7] |
差示扫描量热(DSC)分析: DSC 200 F3型差示扫描量热仪, 德国耐驰公司。样品质量为0.5~1.0 mg, 升温区间为-70~400 ℃, 升温速率分别为2, 5, 10, 20 ℃·min-1, 动态氮气气氛, 流速为30 mL·min-1, 试样皿为铝盘。
热重(TG)分析: TG 209 F3型热重分析仪, 德国耐驰公司。样品质量为0.5~1.0 mg, 升温区间为30~400 ℃, 升温速率为2, 5, 10 ℃·min-1, 动态氮气气氛, 试样皿为铝盘。
3 结果与讨论 3.1 GAPA热分解特性 3.1.1 DSC分析结果GAPA在不同升温速率下(2, 5, 10, 20 ℃·min-1)的DSC曲线如图 1所示。由图 1获得GAPA热分解的特征参数见表 1。
| 表 1 不同升温速率下GAPA的DSC结果 Tab.1 DSC results of GAPA at different heating rates |
从图 1可以看出, GAPA的DSC曲线均为单峰, 当升温速率为10℃·min-1时整个放热过程发生在207.6~276.8℃。随着升温速率的增加, DSC曲线的放热峰向高温方向移动, 放热峰温和放热量逐渐增大, 当升温速率为20℃·min-1时DSC曲线峰温最大, 峰形最尖, 放热速率最快, 这可能是因为GAPA放热速率随着升温速率的增大而增大。
3.1.2 TG分析结果GAPA在升温速率分别为2, 5, 10 ℃·min-1时的TG曲线见图 2, 升温速率为5 ℃·min-1时的TG-DTG曲线见图 3。

|
图 2 不同升温速率下GAPA的TG曲线 Fig.2 TG curves of GAPA at different heating rates |
|
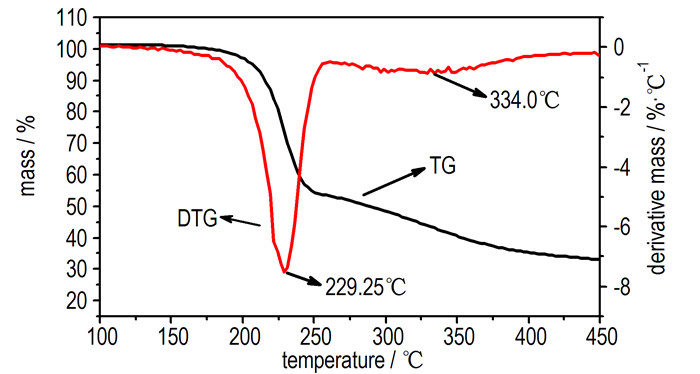
图 3 5 ℃·min-1时GAPA的TG-DTG曲线 Fig.3 TG-DTG curves of GAPA at 5 ℃·min-1 |
从图 2和图 3可知, 不同升温速率下GAPA的TG曲线趋势相似, GAPA加热到约200 ℃才有较明显的质量损失, GAPA的热分解过程包括两个阶段。第一阶段为放热分解阶段, 温度区间为188~248 ℃, 质量损失为44.8%~51.8%, DTG峰温为229.25 ℃, 该阶段为叠氮基团的热分解所致[7], 这与GAPA的氮含量46.15%结果一致; 第二阶段为GAPA骨架裂解阶段, 温度区间为248~400 ℃, 质量损失为25%, DTG峰温为334.0 ℃, 该阶段为碳、氢等的分解, 没有明显的放热效应; 当温度加热到400℃时, 失重百分数随温度的升高而不再变化, 未再有质量损失。
3.2 动力学参数计算 3.2.1 Kissinger法根据GAPA在升温速率2, 5, 10, 20 ℃·min-1时DSC曲线的峰温, 用Kissinger法[8]通过线性回归求得热分解动力学参数。
| $ {\rm{ln}}\frac{{{\beta _i}}}{{{T_{{\rm{p}}i}}^2}} = {\rm{ln}}\frac{{{A_{\rm{K}}}R}}{{{E_{\rm{K}}}}}-\frac{{{E_{\rm{K}}}}}{{R{T_{{\rm{p}}i}}}}\;\;i = 1, 2, 3, 4 $ | (1) |
式中, βi为试样升温速率, ℃·min-1; Tpi为DSC曲线上的第一个峰温, K; EK为表观活化能, J·mol-1; AK为指前因子, s-1; R为理想气体常数, 8.314 J·mol-1·K-1。由lnβi/Tpi2-1/Tpi的关系, 经回归分析求得GAPA的表观活化能EK=218.47 kJ·mol-1, AK=1.06×1022 s-1, 其中线性回归相关性为0.99791, 标准偏差为0.07491。
3.2.2 Ozawa法通过不同升温速率下的TG曲线用非等温法进行热分解动力学研究时, 常用的Ozawa公式[9]为:
| $ {\rm{lg}}\beta = {\rm{lg}}[\frac{{A{E_{\rm{a}}}}}{{RF\left( \alpha \right)}}] -2.315 -0.4567\frac{{{E_{\rm{a}}}}}{{RT}} $ | (2) |
式中, β为试样升温速率, ℃·min -1; A为指前因子, s-1; Ea为表观活化能, J·mol-1; R为理想气体常数, 8.314 J·mol-1·K-1; T为温度, K; α为反应深度; F(α)为机理函数的积分形式。由lnβi-1/Tpi的关系, 经回归分析求得GAPA的表观活化能EO=215.87 kJ·mol-1, 其中线性回归相关性为0.99807, 标准偏差为0.03246。
如果选择相同的α, lgβ与1/T呈线性关系, 由直线的斜率计算活化能, 并用来求解热分解的机理函数。
根据Doyle法[9], (2)式可变换为:
| $ {\rm{lg}}F\left( \alpha \right) = {\rm{lg}}[\frac{{A{E_{\rm{a}}}}}{{R\beta }}] -2.315 -0.4567\frac{{{E_{\rm{a}}}}}{{RT}} $ | (3) |
对任何热分解机理函数, lgF(α)与1/T呈线性关系。对某个假设的反应机理函数, 若通过Doyle法求得的热分解活化能与Ozawa法求得的活化能接近, 且线性相关系数好, 则可由此获得最可几热分解反应机理函数。
本实验的升温速率为2, 5, 10 ℃·min-1, 升温的温度区间为30~400 ℃。从TG曲线对应的失重台阶来看, GAPA热分解主要分为两个阶段, 分别位于反应深度为0.10~0.45和0.45~0.75。对于热分解的第一阶段(0.10~0.45), 根据GAPA的热重曲线求出反应深度分别为0.10, 0.15, 0.20, 0.25, 0.30, 0.35, 0.40, 0.45时所对应的分解温度T。根据公式(2)和试验数据对lgβ与1/T进行线性拟合, 由直线斜率获得表观活化能Ea, 计算结果见表 2, 线性拟合结果见表 3。
| 表 2 由Ozawa法得到的GAPA热分解反应活化能(α=0.10~0.45) Tab.2 Activation energy of the thermal decomposition reaction in the range of 0.10~0.45 of GAPA obtained by Ozawa′s method |
| 表 3 lgF(α)与1/T线性拟合结果(α=0.10~0.45) Tab.3 Liner fitting result of lgF(α)-1/T in the range of 0.10~0.45 |
对30种热分解反应机理函数的相应lgF(α)与1/T进行线性回归分析, 线性拟合结果表明:对于GAPA的热分解, 在反应深度为0.10~0.45阶段的热分解属于随机成核和随后生长, 属于第2号函数, 其积分形式为F(α)=α+(1-α)ln(1-α), 反应机理的微分形式为f(α)=-[ln(1-α)]-1, 表观活化能Ea为192.01 kJ·mol-1, 指前因子A为2.95×1019 s-1, 热分解动力学方程为:
| $ \begin{array}{l} {\rm{d}}\alpha /{\rm{d}}t = kf\left( \alpha \right) = A{{\rm{e}}^{- \frac{E}{{RT}}}}f\left( \alpha \right)\\ \;\;\;\;\;\;\;\;\;\; =- 2.95 \times {10^{19}}{[{\rm{ln}}\left( {1-\alpha } \right)]^{ -1}}{\rm{exp}}( -\frac{{2.31 \times {{10}^4}}}{T}) \end{array} $ | (4) |
同理, 采用Ozawa法对第二个阶段(α=0.50~0.65)进行表观活化能的计算, 根据GAPA的热重分析曲线求出反应深度分别为0.50, 0.55, 0.60, 0.65时所对应的分解温度, 计算结果见表 4, 线性拟合结果见表 5。
| 表 4 由Ozawa法得到的GAPA热分解反应活化能(α=0.50~0.65) Tab.4 Activation energy of the thermal decomposition reaction in the range of 0.50-0.65 of GAPA obtained by Ozawa′s method |
| 表 5 lgF(α)与1/T线性拟合结果(α=0.50~0.65) Tab.5 Liner fitting result of lgF(α)-1/T in the range of 0.50~0.65 |
线性拟合结果表明, 在反应深度为0.50~0.65阶段的热分解属于随机成核和随后生长, n=4机理, 属于第13号函数, 其积分形式为F(α)=[-ln(1-α)]4, 反应机理的微分形式为f(α)=(1/4)(1-α) [-ln(1-α)]-3, 表观活化能Ea为43.44 kJ·mol-1, 指前因子A为8.72×1012 s-1, 热分解动力学方程为:
| $ \begin{array}{l} {\rm{d}}\alpha /{\rm{d}}t = kf\left( \alpha \right) = A{{\rm{e}}^{- \frac{E}{{RT}}}}f\left( \alpha \right)\\ \;\;\;\;\;\;\;\;\;\; = 2.18 \times {10^{12}}\left( {1- \alpha } \right){[-{\rm{ln}}\left( {1-\alpha } \right)]^{ -3}}{\rm{exp}}( -\frac{{5.22 \times {{10}^3}}}{T}) \end{array} $ | (5) |
根据表 1中的β和Tp值由(式6)Tpi=Tp0+bβi+cβi2+dβ3计算出在升温速率β趋于零时DSC曲线上的外推峰温Tp0为223.65 ℃。
GAPA在Tp0时热力学参数反应的活化熵(ΔS≠)、活化焓(ΔH≠)和活化自由能(ΔG≠)由式6、7、8求得[9]。
| $ {A_{\rm{K}}}{\rm{exp}}(-\frac{{{E_{\rm{K}}}}}{{RT}}) = \frac{{{k_{\rm{B}}}{T_{{\rm{p0}}}}}}{h}{\rm{exp}}(-\frac{{\Delta {G^ \ne }}}{{R{T_{{\rm{p0}}}}}}) $ | (6) |
| $ \Delta {H^ \ne } = {E_{\rm{K}}}-R{T_{{\rm{p0}}}} $ | (7) |
| $ \Delta {G^ \ne } = \Delta {H^ \ne }-{T_{{\rm{p0}}}}\Delta {S^ \ne } $ | (8) |
式中, kB为Boltzmann常数, 1.381×10-23J·K-1; h为Planck常数, 6.626×10-34J·s; R为气体常数, 8.314 J·mol-1·K-1; Ak为指前因子, 1.06×1022 s-1; Ek为表观活化能, 218.47 kJ·mol-1
计算GAPA可得分解反应的活化自由能ΔG≠=132.76 kJ·mol-1, 活化焓ΔH≠=214.34 kJ·mol-1以及活化熵ΔS≠=164.21 J·mol-1·K-1。
3.4 热安全性参数计算根据GJB772A-1997方法505.1中的Zhang-Hu-Xie-Li法[10], 按下式计算自发火温度:
| $ {T_{{\rm{bpo}}}} = \frac{{{E_{\rm{K}}}-\sqrt {{E_{\rm{K}}}^2-4{E_{\rm{K}}}R{T_{{\rm{p0}}}}} }}{{2R}} $ | (9) |
式中, EK为表观活化能, J·mol-1; R为气体常数, 8.314 J·mol-1·K-1; Tp0为加热速率趋于零时的外推峰温, K; Tbpo为Zhang-Hu-Xie-Li法处理得到的自发火温度, K。将EK和Tbpo代入(10)式中, 计算得到Tbpo=506.55 K。
根据文献[11], 自加速分解温度可按下式计算:
| $ {T_{{\rm{SADT}}}} = {T_{{\rm{bpo}}}} - \frac{{R{T_{{\rm{bpo}}}}^2}}{{{E_{\rm{K}}}}} $ | (10) |
式中, TSADT为自加速分解温度, K; Tbpo, EK如式(9)。将EK及Tbpo带入(10)式中, 计算可得TSADT=496.78 K。
4 结论(1) GAPA热分解经历两个阶段, 第一阶段为叠氮基团热分解阶段, 温度区间为188~248 ℃, 质量损失为44.8%~51.8%, DTG峰温为229.25 ℃; 第二阶段为骨架裂解阶段, 温度区间为248~400 ℃, 质量损失为25%, DTG峰温为334.0 ℃, 没有明显的放热效应。
(2) GAPA热分解第一阶段属于随机成核和随后生长, 反应机理函数为f(α)=-[ln(1-α)]-1, 热分解动力学方程为:
(3) 由非等温DSC曲线通过Kissinger法计算得到动力学参数, 其中活化能EK为218.47 kJ·mol-1, 指前因子AK为1.06×1022 s-1。
(4) 由Zhang-Hu-Xie-Li法计算出GAPA热力学参数, 其中自发火温度Tbpo为506.55 K, 自加速分解温度TSADT为496.78 K, 以及活化自由能(ΔG≠)、活化焓(ΔH≠)和活化熵(ΔS≠)分别为132.76 kJ·mol-1、214.34 kJ·mol-1和164.21 J·mol-1·K-1。
| [1] |
王平, 郁卫飞, 刘春. 支化聚叠氮缩水甘油醚硝酸酯的制备[J].
含能材料, 2008, 16(6): 395-397. WANG Ping, YU Wei-fei, LIU Chun. Preparation of branched glycidyl azide polymer nitrate[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2008, 16(6): 395-397. |
| [2] |
Farber M, Harris S P, Srivastava R D. Mass spectrometric kinetic studies on several azido polymers[J].
Combustion Flame, 1984, 55(84): 203-211. |
| [3] |
Haas Y, Ben Eliahu Y, W elner S. Welner infrared laser induced decomposition of GAP[J].
Combustion Flame, 1994, 96(3): 201-211. DOI:10.1016/0010-2180(94)90009-4 |
| [4] |
Tang C J, Lee Y J, L itzinger T A. Simultaneous temperature and species measurements of the glycidyl azide polymer (GAP) propellant during laser induced decomposition[J].
Combustion Flame, 1999, 117: 244-256. DOI:10.1016/S0010-2180(98)00112-6 |
| [5] |
王刚, 葛震, 李霄羽, 等. GAPA及GAPA/P(BAMO/AMMO)含能热塑性弹性体的热性能[J].
中国科学:化学, 2015, 45(7): 719-724. WANG Gang, GE Zhen, LI Xiao-yu, et al. The thermal property of GAPA and GAPA/P(BAMO/AMMO)[J]. Science China Chemistry, 2015, 45(7): 719-724. |
| [6] |
徐若千, 姬月萍, 丁峰, 等. 三臂型叠氮含能增塑剂GAPA的合成与性能[J].
含能材料, 2009, 17(6): 681-684. XU Ruo-qian, JI Yue-ping, DING Feng, et al. Synthesis and Properties of Tri-arms glycidyl azide polymer azide[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2009, 17(6): 681-684. |
| [7] |
王晓, 罗运军, 柴春鹏. 端叠氮基聚叠氮缩水甘油醚的合成与热性能[J].
火炸药学报, 2010, 33(6): 57-60. WANG Xiao, LUO Yun-jun, CHAI Chun-peng. Synthesis and thermal Property of azido-terminated glycidyl azide polymer[J]. Chinese Journal of Explosives & Propellant, 2010, 33(6): 57-60. |
| [8] |
Kissinger H E. Reaction kinetics in differential thermal analysis[J].
Analytical Chemistry, 1957, 29(11): 1702-1706. DOI:10.1021/ac60131a045 |
| [9] |
何志伟, 高大元, 刘祖亮. 2, 6-二氨基-3, 5-二硝基吡啶-1-氧化物及其黏结炸药的热分解动力学[J].
火炸药学报, 2009, 32(2): 32-35. HE Zhi-wei, GAO Da-yuan, LIU Zu-liang. Thermal decomposition kinetics of 2, 6-diamino-3, 5-dinitropyridine-1-oxide and its formulation explosives[J]. Chinese Journal of Explosives & Propellant, 2009, 32(2): 32-35. |
| [10] |
胡荣祖, 史启祯.
热分解动力学[M]. 北京: 科学出版社, 2001: 127-131.
HU Rong-zu, SHI Qi-zhen. Thermal analysis kinetics[M]. Beijing: Science Press, 2001: 127-131. |
| [11] |
汤崭, 杨利, 乔小晶, 等. HMX热分解动力学与热安全性研究[J].
含能材料, 2011, 19(4): 396-400. TANG Zhan, YANG Li, QIAO Xiao-jing, et al. On thermal decomposition kinetics and thermal safety of HMX[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2011, 19(4): 396-400. |
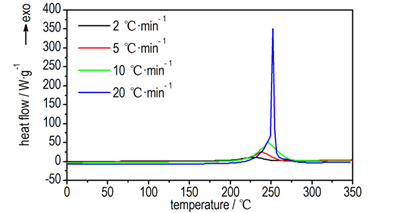
The apparent activation energy, pre-exponential factor and thermal decomposition kinetic equation were studied at heating rates of 2 ℃·min-1, 5 ℃·min-1, 10 ℃·min-1 and 20 ℃·min-1. Its kinetic parameters thermodynamic and thermal safety parameters were calculated.



