氮杂环类化合物常见于我们的日常生活和生产中, 是医药, 农药, 含能材料等多个领域中必不可少的有机中间体和化工原料。因而, 氮杂环类化合物的合成显得格外重要。本课题组主要从事氮杂环类含能材料合成的研究, 醛胺缩合反应是合成氮杂环类化合物的主要方法之一[1-2]。很多高能量密度化合物都具有氮杂环结构, 例如硝基甘脲类化合物作为一类高能量密度化合物, 具有能量高、高密度、稳定性良好等优点; 2, 5, 7, 9-四硝基-2, 5, 7, 9-四氮杂双环[4,3,0]壬-8-酮, 俗称K-56, 是一种氮杂环高能量密度材料, 其晶体密度为1.92 g·cm-3, Kamlet公式计算爆速为9015 m·s-1, 爆压为37.67 GPa[3]; 此外被称为高能炸药代表的六硝基六氮杂异伍兹烷(HNIW)[4-7], 是一个由两个五元环及一个六元环组成的笼形硝胺, 在很多方面都有优良的性能, 如晶体密度达2.04~2.05 g·cm-3、爆速达9.5~9.6 km·s-1、爆压达43~44 GPa等。很多氮杂环类含能化合物都在已被研制或正在研制过程中, 而研制过程中所用催化剂大多为传统强腐蚀性无机酸, 且催化性能并不是很好, 不仅对设备腐蚀严重, 而且后处理时产生大量的含酸废水, 严重污染了环境[8]。
离子液体是一种新型的绿色催化剂, 主要由有机阳离子、无机或有机阴离子构成, 是一种在室温或近室温下呈液态的盐类, 具有较好的热稳定性、溶解性和不挥发、不易燃、不易爆等特性, 是绿色化学发展的方向之一[9-13]。离子液体在有机合成中的应用极其广泛, 并显示出反应速率快、转化率高、选择性高、可循环使用等优点[14]。离子液体在醛胺缩合等有机合成反应中表现出很高的催化活性, 能有效地促进多种有机缩合反应的进行, 显著地提高反应的选择性和收率, 显示出美好的应用前景。Wang[15]报道了离子液体催化下2, 5-己二酮和脂肪胺或芳香胺的缩合反应, 发现在离子液体中, 无需外加催化剂, 室温下即可快速生成单一产物吡咯。Ranu[16]等利用离子液体催化邻苯二胺与芳香醛的缩合反应, 合成苯并咪唑类化合物, 在室温下反应4~7 h, 收率大于80%, 且离子液体多次重复使用效果良好。文献[17]利用室温离子液体作为催化剂, 催化芳香醛、尿素和乙酰乙酸乙酯三组分发生缩合反应, 制备3, 4-二氢嘧啶2-酮化合物, 反应条件温和, 时间短, 且不需要另外添加溶剂。
目前, 使用酸性离子液体催化醛胺缩合反应的研究报道相对较少, 同时使用的酸性离子液体一般比较老旧, 在各类化学反应中的应用较为局限, 因此合成新型酸性离子液体显得尤为重要。本研究设计合成了一种新型酸性离子液体1-十二烷基-3-丙磺酸基咪唑硫酸氢盐[C3SO3HDoim]HSO4, 同时以三种已有酸性离子液体作为比较, 探索酸性离子液体催化醛胺缩合反应制备多氮杂环化合物的催化性能。选取的三种氮杂环化合物分别为甘脲、2, 5, 7, 9-四氮杂双环[4.3.0]壬酮-8和六苄基六氮杂异伍兹烷。
2 实验部分 2.1 试剂与仪器试剂:N-甲基咪唑(99%)、1, 3-丙烷磺酸内酯(99%):上海阿拉丁生化科技股份有限公司; 三乙胺、脲、乙二胺、乙二醛:国药集团化学试剂有限公司; 以上试剂均为分析纯。
仪器:红外光谱由NICOLET Impact 410型红外光谱仪测定(KBr压片); 1H NMR在Bruker AVANCE 300(500 MHz)上测定; 13C NMR在Bruker AVANCE 300(125 MHz)上测定; 质谱由FININIGAN Trace Ultra-Trace DSQ GC/MS检测新型酸性离子液体催化剂, 产物熔点测定采用SGWX-4熔点仪, 元素分析由Vario EL Ⅲ型元素分析仪测定。
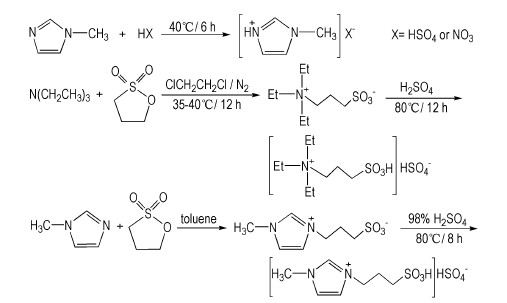
2.2 实验过程 2.2.1 酸性离子液体的合成N-甲基咪唑酸盐离子液体[18][HMim]X(X=HSO4、NO3), 三乙铵基丙磺酸硫酸氢盐[8][TEPSA]HSO4和1-甲基-3-丙磺酸基咪唑硫酸氢盐[19][C3SO3HMim]HSO4的合成分别按照文献所示方法, 合成路线见Scheme 1。[HMim]HSO4, 1H NMR(DMSO-d6, 500 MHz), δ:3.82(s, 3H), 7.45(s, 1H), 7.51(s, 1H), 8.81(s, 1H); [TEPSA]HSO4, 1H NMR(DMSO-d6, 500 MHz), δ:1.15(t, J=5.0, 9H), 1.85~1.91(m, 2H), 2.54(t, J=5.0, 2H), 3.17~3.21(m, 6H), 3.26~3.30(m, 2H); [C3SO3HMim] HSO4, 1H NMR(DMSO-d6 500 MHz), δ:2.10~2.15(m, 2H), 2.53~2.56(t, 2H), 3.87(s, 3H), 4.30~4.33(t, 2H), 7.71(s, 1H), 7.79(s, 1H), 9.13(s, 1H)。MS(ESI) [M+H]+:m/z 205.04。
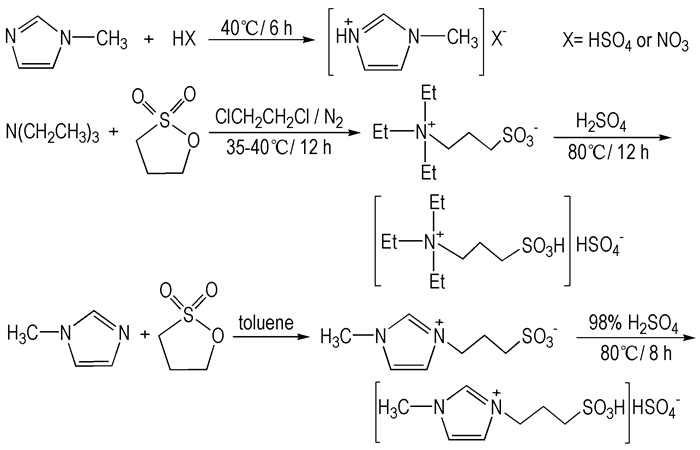
|
Scheme 1 Synthesis of acidic ionic liquids |
1-十二烷基-3-丙磺酸基咪唑硫酸氢盐[C3SO3HDoim]HSO4的合成
第一步:在120 mL新制备的1 mol·L-1乙醇钠/乙醇溶液中加入咪唑(0.1 mol, 6.8 g), 70 ℃恒温反应8 h, 制得红棕色的咪唑钠乙醇溶液[20-21], 向其中加入等摩尔的1-溴十二烷, 70 ℃反应8 h, 生成白色固体沉淀, 抽滤, 滤液用无水乙醚(3×30 mL)萃取, 减压蒸馏除去有机溶剂得到N-十二烷基咪唑21.5 g, 产率91.1%。第二步:在无溶剂条件下, 向第一步产品中加入等摩尔的1, 3-丙烷磺酸内酯, 控制50 ℃反应10 h得黄褐色粘稠液体, 再加入等摩尔的98%硫酸, 80 ℃反应6 h, 生成无色至淡黄色粘稠液体, 经真空干燥4 h除去水分, 无水乙醚(3×30 mL)洗涤, 90 ℃真空干燥4 h, 即得到酸性离子液体[C3SO3HDoim]HSO434.8 g, 产率83.9%。如Scheme 2所示。1H NMR(DMSO-d6 500 MHz), δ:0.77(t, J=5.0, 3H), 1.16(s, 19H), 2.04~2.11(m, 3H), 2.45~2.51(m, 3H), 3.38~3.40(m, 1H), 4.25(t, J=5.0, 3H), 7.70(s, 2H), 9.07(s, 1H); 13C NMR(DMSO-d6, 125 MHz), δ:13.18, 21.97, 25.45, 25.75, 25.82, 28.13, 28.24, 28.38, 28.55, 29.25, 29.42, 31.08, 47.39, 48.54, 48.90, 122.38, 122.44, 135.96.IR(KBr, ν/cm-1):3147, 2926, 2857, 1697, 1564, 1456, 1138, 1026, 865, 741, 573;MS(ESI) [M+H]+:m/z 359.17.Anal.Calcd.for C18H36N2S2O7:C 47.34, H 7.95, N 6.14, S 14.04;Found C 47.56, H 7.92, N 6.23, S 14.07。
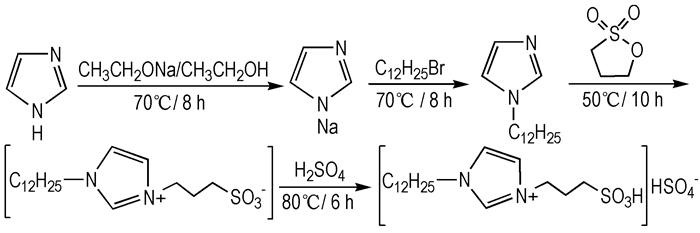
|
Scheme 2 Synthesis of [C3SO3HDoim]HSO4 |
四氢-咪唑并[4, 5-d]咪唑-2, 5-二酮(甘脲)的合成[22]:
将NH2CONH2, H2O依次加入三口瓶中, 搅拌溶解后升温至80 ℃, 缓慢滴加酸性离子液体, 调节溶液pH=2, 加入40%乙二醛水溶液, 保温反应5 h。冷却至室温后抽滤, 滤饼依次用水, 丙酮洗涤, 真空干燥得白色固体。如Scheme 3所示。m.p.296~298 ℃; 1H NMR(DMSO-d6, 500 MHz), δ:5.24(s, 2H), 7.17(s, 4H); 13C NMR(DMSO-d6, 125 MHz), δ:162.13, 65.42;IR(KBr, ν/cm-1):3310, 1760, 1680, 1514, 1410, 1340, 1242, 1107, 996, 890, 760, 606, 469。Anal.Calcd.for C4H6N4O2:C 33.80, H 4.26, N 39.43;Found C 33.82, H 4.38, N 39.50。
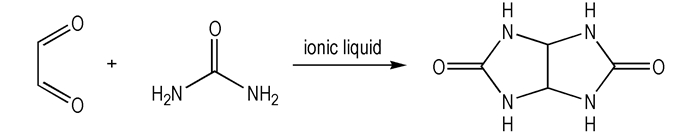
|
Scheme 3 Synthesis of tetrahydroimidazo[4, 5-d]imidazole-2, 5-(1H, 3H) -dione |
2, 5, 7, 9-四氮杂双环[4.3.0]壬酮-8的二盐酸盐一水合物的合成[23]:
30 ℃搅拌下, 将7.4 mL 99%乙二胺滴加入装有12 mL 40%乙二醛水溶液的三口瓶中, 调节pH值至9.5, 保温40 min, 冷至10~15 ℃; 加入一定量的离子液体, 搅拌下滴加37%的盐酸, 然后加入6 g脲, 30 ℃下搅拌4 h。抽滤, 乙醇洗涤滤饼, 烘干得产物。如Scheme 4所示。m.p.163~166 ℃; 1H NMR(DMSO-d6, 500 MHz), δ:3.83(t, 4H), 5.23(s, 2H), 7.64(s, 2H), 8.38(s, 4H); 13C NMR(DMSO-d6, 125 MHz), δ:161.63, 64.95, 35.61;IR(KBr, ν/cm-1):3400, 3205, 2935, 2745, 1763, 1705, 1540, 1450, 1415, 1254, 1120。Anal.Calcd.for C5H14N4O2Cl2:C 25.70, H 5.97, N 23.69;Found C 25.74, H 6.05, N 23.95。
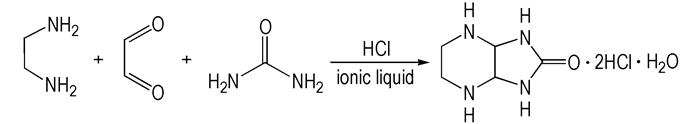
|
Scheme 4 Synthesis of 2, 5, 7, 9-tetrazobicyclo[4,3,0]nonan-8-one |
六苄基六氮杂异伍兹烷(HBIW)的合成[24]:
取乙腈、水、苄胺加入三口瓶中, 滴加一定量离子液体。搅拌20 min, 滴加40%乙二醛水溶液, 以冷水冷却反应。加料后继续搅拌15 min, 室温下放置一段时间, 抽滤, 冷乙腈洗涤滤饼, 烘干得粗品HBIW。将粗品放入丙酮中, 60 ℃回流2 h, 室温静置24 h, 抽滤, 冷乙腈洗涤, 得白色针状晶体。如Scheme 5所示。m.p.158~159 ℃; 1H NMR(CDCl3, 300 MHz), δ:3.64(s, 2H), 4.10~4.22(m, 16H), 7.24~7.35(m, 30H); 13C NMR(CDCl3, 75 MHz), δ:140.71, 129.15, 128.31, 128.11, 128.03, 126.70, 126.60, 80.58, 77.42, 56.85, 56.18;IR(KBr, ν/cm-1):2900, 2700, 1498, 1456, 1354, 1170, 970, 920, 720。Anal.Calcd.for C48H48N6:C 81.32, H 6.82, N 11.86;Found C 81.40, H 6.95, N 11.93。
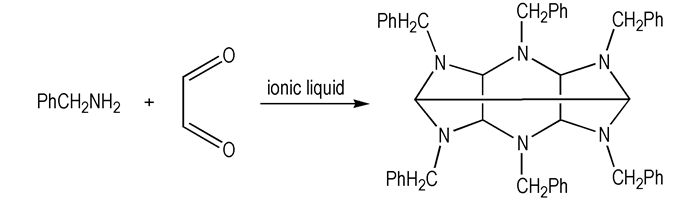
|
Scheme 5 Synthesis of HBIW |
按2.2.2节所述实验方法进行缩合反应, 实验条件为:脲(100 mmol), 40%乙二醛水溶液(50 mmol), 酸性离子液体(5 mmol), 反应时间5 h, 反应温度90 ℃。结果见表 1。
| 表 1 不同催化剂对反应的影响 Tab.1 Influence of different catalysts on reaction |
表 1结果表明, 在给定条件下, 相比于传统的无机酸催化剂, 离子液体表现出较强的催化活性, 且用量少。而选取的几种离子液体中, 1-十二烷基-3-丙磺酸基咪唑硫酸氢盐催化性能最好(No.7), 这可能是由于其功能化官能团磺酸基团和十二烷基的作用导致的。磺酸基团是亲水性的, 而十二烷基碳链易溶于有机相, 这使得此种离子液体能够很好地参与反应。
3.1.2 离子液体[C3SO3HDoim] HSO4催化合成甘脲反应条件的优化按2.2.2节所述实验方法进行缩合反应, 实验条件为:脲(100 mmol), 40%乙二醛水溶液(50 mmol), 结果见表 2。
| 表 2 甘脲合成反应条件的优化 Tab.2 Optimization of the synthesis reaction conditions of glycoluril |
表 2结果表明, 随着离子液体用量的增加, 甘脲的收率也越高, 当离子液体用量过高时, 收率反而下降, 这可能是溶剂化效应导致的结果(No.1 ~No.3)。另外, 反应温度对收率也有一定影响, 90 ℃是反应的最佳温度, 过高过低对产率都会产生影响(No.2, No.4, No.5)。最佳反应时间为5 h, 延长反应时间并不能增加收率。
离子液体[C3SO3HDoim]HSO4对合成甘脲的醛胺缩合反应催化活性好, 操作简单, 产物易分离。鉴于离子液体[C3SO3HDoim]HSO4较强的催化性能, 笔者曾尝试将其应用于其他含能材料中间体的合成, 如2, 5, 7, 9-四氮杂双环[4.3.0]壬酮-8, 六苄基六氮杂异伍兹烷(HBIW)等, 以期达到较好的效果。
3.2 离子液体[C3SO3HDoim]HSO4催化2, 5, 7, 9-四氮杂双环[4.3.0]壬酮-8的合成按2.2.2节所述实验方法进行缩合反应, 实验条件为:99%乙二胺(7.4 mL), 40%乙二醛(12 mL), 一定量离子液体[C3SO3HDoim]HSO4, 37%浓盐酸, 脲(0.1 mol, 6 g)。结果见表 3。
表 3结果表明, 在盐酸存在下, 离子液体[C3SO3HDoim]HSO4作为反应的促进剂, 随着离子液体用量的增大, 产率逐渐增大; 当离子液体用量为脲用量的10%时, 产率最高; 再次增加离子液体用量时, 产率反而降低。因此, 离子液体用量为脲用量的10%时, 效果最好(No.1 ~No.4)。当仅有离子液体, 无盐酸参与反应时, 产率低至40%, 这说明产率的提高是离子液体和盐酸同时作用的结果(No.5和No.6)。
| 表 3 离子液体和盐酸用量对化合物产率的影响 Tab.3 Effect of ILs and HCl loading on the yield |
根据本课题组前期研究成果[25], 推测本反应可能的机理如Scheme 6所示, 首先乙二醛和乙二胺缩合生成2, 3-二羟基哌嗪, 后者脱去两分子水生成希夫碱, 然后在盐酸和酸性离子液体中希夫碱进一步生成亚胺正离子, 而亚胺正离子活性高易于脲发生缩合反应, 形成盐酸盐的水合物析出。酸性离子液体存在, 不仅在于其改变了溶液的离子环境, 而且其阳离子起到了表面活性剂的作用, 使得此水合物易于析出。
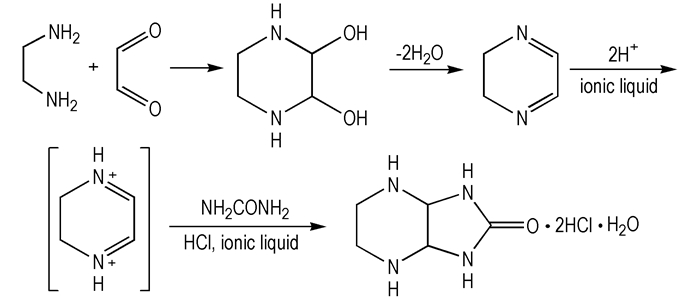
|
Scheme 6 The mechanism for the synthesis of 2, 5, 7, 9-tetrazobicyclo[4,3,0]nonan-8-one |
按2.2.2节所述实验方法进行缩合反应, 实验条件为:乙腈55 mL, 水(5 mL), 苄胺(5.9 g, 55 mmol), 40%乙二醛(3.63 g), 一定量酸性离子液体[C3SO3HDoim]HSO4。结果见表 4。
| 表 4 六苄基六氮杂异伍兹烷合成反应条件的优化 Tab.4 Optimization of the synthesis reaction conditions of HBIW |
表 4结果表明, 随着离子液体用量增加, HBIW产率逐渐提高, 达到3 mmol时HBIW产率最高达81%。再增加离子液体用量, HBIW产率明显降低。这是因为该缩合反应所需要的pH值应为9.5左右[24], 酸性条件下, pH值过低, 则会抑制缩合反应的进行。反应液静置时间为10 h时, HBIW产率最高, 随着时间加长, 产率有些许降低, 这可能是由于溶剂化作用使HBIW难于析出导致的。故当酸性离子液体[C3SO3HDoim]HSO4加入量为3 mmol, 静置时间达10 h, HBIW收率最高, 可达81%。
3.4 离子液体[C3SO3HDoim]HSO4的重复使用从经济和环境保护方面考虑, 催化剂的循环利用性能是考察催化材料的一项重要指标, 而离子液体的一个重要特征就是可循环使用。本实验着重考察了离子液体[C3SO3HDoim]HSO4的重复使用性能。反应结束滤出产物, 催化体系经减压蒸馏除去大部分水分和有机溶剂后, 不需进一步处理, 直接应用在下次反应中, 其使用性能如图 1所示。实验结果表明, 对于三种含能材料中间体的合成, 离子液体[C3SO3HDoim]HSO4均可以重复使用6次, 其催化性能变化不大, 催化活性的稍微降低可能与产物分离时离子液体的流失有关。离子液体的重复使用研究, 均是在最优实验条件下进行的。甘脲(A):脲(100 mmol), 40%乙二醛水溶液(50 mmol), [C3SO3HDoim]HSO4(5 mmol), 反应时间5 h, 反应温度90 ℃; 2, 5, 7, 9-四氮杂双环[4.3.0]壬酮-8(B):99%乙二胺(7.4 mL), 40%乙二醛(12 mL), [C3SO3HDoim]HSO4(10 mmol), 37%浓盐酸(20mL), 脲(0.1 mol, 6 g); HBIW(C):乙腈55 mL, 水(5 mL), 苄胺(5.9 g, 55 mmol), 40%乙二醛(3.63 g), [C3SO3HDoim]HSO4(3 mmol), 静置时间为10 h。
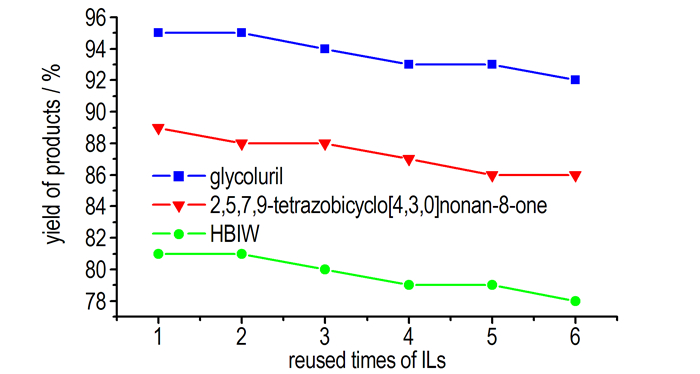
|
图 1 离子液体的重复使用 Fig.1 Recyclability of ILs |
(1) 设计合成了一种新型酸性离子液体1-十二烷基-3-丙磺酸基咪唑硫酸氢盐[C3SO3HDoim]HSO4, 并通过1H NMR, 13C NMR, IR, MS, 元素分析进行了表征。
(2) 以酸性离子液体[C3SO3HDoim]HSO4为催化剂, 制备氮杂环化合物甘脲、2, 5, 7, 9-四氮杂双环[4.3.0]壬酮-8和六苄基六氮杂异伍兹烷, 并进行了表征, 探索了合成的最佳条件, 收率分别为95%, 89%, 81%。
(3) 新型酸性离子液体[C3SO3HDoim]HSO4对催化醛胺缩合反应制备多氮杂环化合物有较好的催化活性, 反应结束滤出产物, 催化体系经减压蒸馏后无需进一步处理即可进行下次实验, 且能重复使用6次, 而催化性能基本保持不变。
| [1] |
张志忠, 王伯周, 姬月萍, 等. 部分新型高能量密度材料的国内研究进展[J].
火炸药学报, 2008, 31(2): 93-97. ZHANG Zhi-zhong, WANG Bo-zhou, JI Yue-ping, et al. Study progress of several high energy density materials(HEDM)[J]. Chinese Journal of Explosives & Propellants, 2008, 31(2): 93-97. |
| [2] |
王文俊. 含能材料技术的进展与展望[J].
固体火箭技术, 2003, 26(3): 42-45. WANG Wen-jun. Advances and prospects of energetic material technologies[J]. Journal of Solid Rocket Technology, 2003, 26(3): 42-45. |
| [3] |
陆明, 吕春绪, 魏运洋. 2, 5, 7, 9-四硝基-2, 5, 7, 9-四氮杂双环[4, 3, O]壬-8-酮的合成及其性能[J].
南京理工大学学报, 1995, 19(4): 325-327. LU Ming, Lü Chun-xu, WEI Yun-yang. Synthesis and property of 2, 5, 7, 9-tetranitro-2, 5, 7, 9-tetrazobicyclo[4, 3, 0]nonan-8-one[J]. Journal of Nanjing University of Science and Technology, 1995, 19(4): 325-327. |
| [4] |
Nielsen A T, Chaafin A P, Chriostian S L, et a1. Synthesis of polyazapolycyclic-caged poly nitramines[J].
Tetrahedron, 1998, 54(39): 11793-11812. DOI:10.1016/S0040-4020(98)83040-8 |
| [5] |
Duddu R G, Dave P R. Processes and compositions for nitration of N-substituted isowurtzitane compounds with concentrated nitric acid at elevated temperatures to form HNIW and recovery of gamma HNIW with high yields and purities: US 015898[P]. 2000-01-18.
|
| [6] |
Nielsen A. T. Caged poly nitramine compound: US 5693794[P]. 1997-12-02.
|
| [7] |
Nikolay V L, Ulf W, Patrick G. Synthesis and scale-up of HNIW from 2, 6, 8, 12-tetraacetyl-4, 10-dibenzyl-2, 4, 6, 8, 10, 12-hexazaisowurtzitane[J].
Org Procees Res Dev, 2000, 4(3): 156-158. DOI:10.1021/op990097d |
| [8] |
方东. 离子液体的制备及其在精细有机合成中的应用研究[D]. 南京: 南京理工大学, 2008.
FANG Dong. Preparation of ionic liquids and its application in fine organic synthesis[D]. Nanjing: Nanjing University of Science and Technology, 2008. |
| [9] |
Rogers R D, Seddon K R.
Ionic liquids:fundamentals, progress, challenges, and opportunities[M]. Washington, DC: American Chemical Society, 2005.
|
| [10] |
费腾, 蔡会武, 李志敏, 等. 双(咪唑)硼烷类自燃离子液体的合成、表征及性质[J].
含能材料, 2015, 23(10): 952-958. FEI Teng, CAI Hui-wu, LI Zhi-min, et al. Synthesis, characterization and properties of bis(imidazole) dihydroboronium hypergolic ionic liquids[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2015, 23(10): 952-958. DOI:10.11943/j.issn.1006-9941.2015.10.007 |
| [11] |
田均均, 张庆华. 含能离子液体——新型离子炸药和绿色推进剂燃料[J].
含能材料, 2014, 22(5): 580-581. TIAN Jun-jun, ZHANG Qing-hua. Energetic ionic liquids——new explosives and green propellant fules[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2014, 22(5): 580-581. |
| [12] |
厉刚, 孙甜甜. 四种叠氮铵类离子液体的合成及其物性研究[J].
含能材料, 2014, 22(2): 136-140. LI Gang, SUN Tian-tian. Synthesis and physicochemical properties of four azidoamoinium-based ionic liquid[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2014, 22(2): 136-140. |
| [13] |
张光全. 离子液体在含能材料领域的应用进展[J].
含能材料, 2012, 20(2): 240-247. ZHANG Guang-quan. Application progress of ionic liquids in energetic materials[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2012, 20(2): 240-247. |
| [14] |
曾家豫, 刘雄雄, 孔维宝, 等. 离子液体的特性及其在生物催化和生物转化中的应用[J].
分子催化, 2010, 24(4): 378-385. ZENG Jia-yu, LIU Xiong-xiong, KONG Wei-bao, et al. Properties of ionic liquid and its application in biocatalysis and biotransformation[J]. Journal of Molecular Catalysis, 2010, 24(4): 378-385. |
| [15] |
WANG Bo, GU Yan-long, YANG Tao, et al. Pyrrole synthesis in ionic liquids by Paal-Knorr condensation under mild conditions[J].
Tetrahedron Lett, 2004, 45: 3417-3419. DOI:10.1016/j.tetlet.2004.03.012 |
| [16] |
Saha D, Saha A, Ranu B C. Rmarkable influence of substituent in ionic liquid in control of reaction:simple, efficient and hazardous organic solvent free procedure for the synthesis of 2-aryl benzimidazoles promoted by ionic liquid[Pmim]BF4[J].
Green Chem, 2009, 11: 733-737. DOI:10.1039/b823543k |
| [17] |
PENG Jia-jian, DENG You-quan. Ionic liquids catalyzed Biginelli reaction under solvent-free conditions[J].
Tetrahedron Lett, 2001, 42: 5917-5919. DOI:10.1016/S0040-4039(01)01139-X |
| [18] |
齐秀芳. Bronsted酸性离子液体存在下硝化(解)反应研究[D]. 南京: 南京理工大学, 2008.
QI Xiu-fang. Nitration(Nitrolysis) reaction under the presence Bronsted acidic ionic liquids[D]. Nanjing: Nanjing University of Science and Technology, 2008. http://d.wanfangdata.com.cn/Thesis/Y1542690 |
| [19] |
CAI Shuang-fei, WANG Li-sheng, YAN Guo-qing, et al. Solubilities of 1-Methyl-3-(3-sulfopropyl)-imidazolium hydrogen sulfate in selected solvents[J].
Chem Eng Chin, 2010, 18(6): 1008-1012. DOI:10.1016/S1004-9541(09)60160-9 |
| [20] |
职慧珍. 具有温控两相性质的聚乙二醇型双子离子液体及其在有机合成中的应用[D]. 南京: 南京理工大学, 2009.
ZHI Hui-zhen. PEG-based dicationic ionic liquids exhibiting temperature-dependent phase behavior and their applications in organic reactions[D]. Nanjing: Nanjing University of Science and Technology, 2009. http://d.wanfangdata.com.cn/Thesis/Y1542664 |
| [21] |
Cole A C, Jensen J L, I Ntai L, et al. Novel bronsted acidic ionic liquids and their use as dual solvent-catalysts[J].
J Am Chem Soc, 2002, 124(21): 5962-5963. DOI:10.1021/ja026290w |
| [22] |
安乔. 甘脲的硝基衍生物的合成研究[D]. 南京: 南京理工大学, 2013.
AN Qiao. Synthesis of nitroderivatives of glycoluril[D]. Nanjing: Nanjing University of Science and Technology, 2013. http://cn.bing.com/academic/profile?id=bee2a5ff71c0722dae232ecb3ceb6821&encoded=0&v=paper_preview&mkt=zh-cn |
| [23] |
刘小兵. 离子液体体系中氮杂环化合物的合成研究[D]. 南京: 南京理工大学, 2012.
LIU Xiao-bing. Study on synthesis of nitrogen-containing heterocyclic compounds in ionic liquid systems[D]. Nanjing: Nanjing University of Science and Technology, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10288-1012320992.htm |
| [24] |
欧育湘, 徐永江, 刘利华, 等. 乙腈法与乙醇法合成六苄基六氮杂异伍兹烷的比较[J].
含能材料, 1999, 7(4): 152-155. OU Yu-xiang, XU Yong-jiang, LIU Li-hua, et al. Comparison of acetonitrile process with ethanol process for synthesis of hexabenzylhexaazaisowurtzitane[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 1999, 7(4): 152-155. |
| [25] |
陆明, 魏运洋, 吕春绪, 等. 2, 5, 7, 9-四硝基-2, 5, 7, 9-四氮杂双环[4.3.0]壬-8酮的合成[J].
应用化学, 1994, 11(5): 110-111. LU Ming, WEI Yun-yang, Lü Chun-xu, et al. Synthesis of 2, 5, 7, 9-tetranitro-2, 5, 7, 9-tetrazobicyclo[4, 3, 0]nonan-8-one[J]. Chinese Journal of Applied Chemistry, 1994, 11(5): 110-111. |
A novel acidic ionic liquid (IL) [C3SO3HDoim]HSO4 was designed and synthesized as the catalyst for condensation reaction of aldehyde and amine, which are multi-nitrogen heterocyclic compounds. The recycling performance of [C3SO3HDoim]HSO4 was also investigated.




