2. 北京理工大学爆炸科学与技术国家重点实验室, 北京 100081
2. State Key Laboratory of Explosion Science and Technology Beijing Institute of Technology, Beijing 100081, China
富氮含能化合物在高能炸药、固体火箭推进剂、气体发生剂和无烟烟火燃料等领域有着重要的应用前景。近年来,富氮含能化合物的合成与理论研究异常活跃,其中主要是对唑类(三唑、四唑、五唑、吡唑、1,2,4-噁二唑)、嗪类(四嗪、三嗪)和呋咱类等富氮含能化合物的研究[[1-3]。
以往文献报道的很多唑类和嗪类富氮含能化合物一般都不含氧原子[4-5],比如3,6-双(1-氢-1,2,3,4-四唑-5-氨基)-1,2,4,5-四嗪(密度1.76 g·cm-3)[6]和4,4′,6,6′-四叠氮基偶氮-1,3,5-三嗪(密度1.72 g·cm-3)[7]。2018年,Chen等[8]也报道了无氧富氮含能化合物3,6-二-[2(-4,6-二叠氮-1,3,5-三嗪-2-基)-肼基]-1,2,4,5-四嗪(密度1.76 g·cm-3)的合成。一般来说,无氧富氮含能化合物存在密度和氧平衡偏低等不足。将氧原子引入富氮化合物中,可以使分子更加容易达到氧平衡,而且还能提高富氮含能化合物的密度,这样有利于发挥富氮化合物作为能量材料的最大威力,所以本文综述了近年来含氧富氮含能化合物(唑类和嗪类)的合成方法。按照氧的存在类型不同,本文将含氧富氮含能化合物主要分为硝基氧富氮含能化合物、羟基氧富氮含能化合物、配位氧富氮含能化合物、羰基氧富氮含能化合物和复合氧富氮含能化合物等五类,系统综述了这些化合物的合成路线。同时,对含氧富氮含能化合物的发展前景进行了展望。由于离子型含能化合物容易由共价型化合物衍生而成,所以本文主要综述了共价型含氧富氮含能分子的合成方法,并期望通过含氧富氮化合物的合成方法综述,为未来设计更为优异的新型含氧富氮化合物提供参考。
2 硝基氧富氮含能化合物大多数富氮含能化合物的主要骨架为三唑、四唑、吡唑、咪唑、三嗪和四嗪环。唑环和嗪环都是含氮量和能量较高的一种氮杂环结构单元。硝基可以提高含能材料的爆轰性能,同时能够有效地改善含能化合物的氧平衡,所以硝基与唑环或嗪环相结合的富氮化合物一般具有高密度、高生成焓和良好的氧平衡等特点。另外,硝基是强吸电子基团,可以增加含氢富氮含能化合物的酸性,有利于构建含能离子盐,这样可以拓展硝基氧富氮化合物的应用范围,所以目前关于硝基氧富氮含能化合物的合成研究十分活跃。
2.1 二硝基富氮含能化合物Fischer等[9]以碳酸二甲酯为起始原料,通过环化和硝化反应得到1,5-二硝氨基四唑(DNATZ),合成路线如Scheme 1所示。DNATZ的密度为1.93 g·cm-3,爆压为43.4 GPa,爆速为9.97 km · s-1,生成焓为486.3 kJ·mol-1。由爆轰数据可以看出,DNATZ爆轰性能比较优良。DNATZ分子中含有两个硝胺基,与硝基相比,硝胺基能使化合物的生成焓显著增加,进而显著提升分子的能量水平。但是硝胺基含有酸性氢,这会降低分子的稳定性。

|
Scheme1 Synthesis of 1, 5-dinitraminotetrazole[9] |
Dippold等[10]以商业上容易得到的3,5-二氨基-1,2,4-三唑为原料,通过多步反应得到5,5 ′-二硝氨基-3,3 ′-偶氮-1,2,4-三唑(DNTAT),合成路线如Scheme 2所示。DNTAT的密度为1.85 g·cm-3,爆压为33.7 GPa,爆速为8.78 km·s-1,生成焓为647.7 kJ·mol-1。DNTAT分子中含有偶氮基,而偶氮基不仅可以明显提高富氮含能化合物的含氮量以及生成焓、密度、爆速和爆压,而且偶氮基的共轭结构能增加整个分子的稳定性、改善熔点。

|
Scheme2 Synthesis of 5, 5 ′-dinitrimino-3, 3 ′-azo-1, 2, 4-triazole[10] |
Fu等[11]从3,4-二硝基-5-甲酰基吡唑出发,经过重排和环化等反应,得到四唑基吡唑基胺(HANTP),合成路线如Scheme 3所示。HANTP的密度为1.85 g·cm-3,爆压为38.3 GPa,爆速为9.26 km ·s-1,生成焓为848.0 kJ·mol-1。可以看出,HANTP的生成焓非常高,爆速也很大,说明硝基和唑环的协同作用可以导致化合物的生成焓升高。HANTP分子中还含有氨基,氨基对分子的安全性有积极的改善作用,有利于降低感度,降低分子的能量。
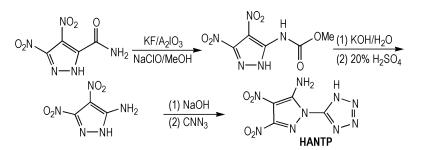
|
Scheme3 Synthesis of tetrazolylpyrazolylamine[11] |
Shlomovich等[12]以3,6-二氯-1,2,4,5-四嗪与3,5-二氨基-1,2,4-三唑为原料,通过硝化反应得到1,2,4,5-四嗪-二(1,2,4-三唑)(TZBTZ),合成路线如Scheme 4所示。TZBTZ的密度为1.86 g·cm-3,爆压为30.6 GPa,爆速为8.61 km·s-1,生成焓为792.6 kJ·mol-1,摩擦感度大于360 N(BAM试验)。TZBTZ分子中含有六元杂环四嗪骨架,由于六元杂环的结构比较松散,环平面容易扭曲,空间结构不紧凑,所以密度较低,但在其结构中引入硝基,不仅可以提高密度,还可以提高生成焓。TZBTZ分子中的氨基有利于改善化合物的稳定性和感度。
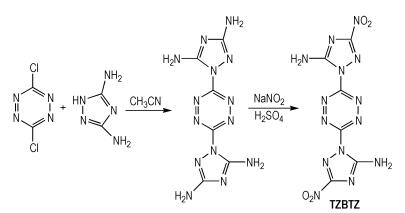
|
Scheme4 Synthesis of 1, 2, 4, 5-tetrazine-bis-1, 2, 4-triazole [12] |
Chavez等[13]以乙二酸和氨基胍盐酸盐(AGH)为原料,三甲基苯磺酰基-O-羟胺(MSH)为胺化试剂,得到1,2,3,4-四嗪稠环化合物(TAT),合成路线如Scheme 5所示。TAT的密度为1.91 g·cm-3,爆压为38.0 GPa,爆速为9.41 km·s-1,生成焓为787.0 kJ·mol-1。TAT中既有硝基又有稠环,其爆轰性能比较优良。稠环化合物刚性更好,所以密度也更高;此外,稠环骨架的环张力更大,提高了化合物的生成焓,增强了含能材料的综合性能。
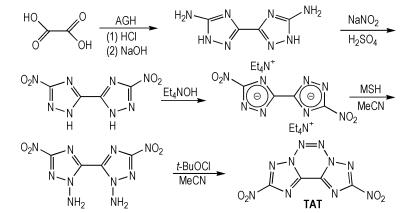
|
Scheme5 Synthesis of triazole annulated with tetrazine[13] |
综上,DNATZ、DNTAT和TZBTZ的合成工艺都比较简单,各种原料都可以商业上得到,是一种较好的合成路线,可以开展放大合成研究。在HANTP的合成中,起始原料不能商业上得到,需要制备。虽然TAT的合成步骤较多,但是起始原料都能商业上得到。
2.2 四硝基富氮含能化合物Hermann等[14]以商业上容易得到的氨基胍碳酸盐和丙二酸为原料,合成得到3-三硝基甲基-5-硝胺基-1,2,4-三唑(TNMANT),合成路线如Scheme 6所示。TNMANT的密度为1.91 g·cm-3,爆压为36.9 GPa,爆速为9.25 km·s-1,生成焓为269 kJ·mol-1。TNMANT分子中含有硝胺基和硝仿基,而硝仿基的存在往往会降低化合物的生成焓,所以该含能化合物的生成焓并不高。
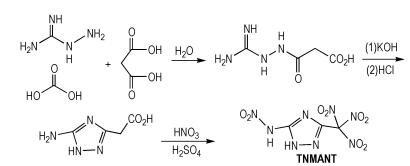
|
Scheme6 Synthesis of 3-trinitromethyl-5-nitramino-1, 2, 4-triazole[14] |
Tang等[15]以乙二酰氯和乙基乙烯基醚为起始原料,经过多步反应得到四硝基二吡啶并1,2,3,4-四嗪(TNDPT),合成路线如Scheme 7所示。TNDPT的密度为1.96 g·cm-3,爆压为44.0 GPa,爆速为9.63 km·s-1,生成焓为758.5 kJ·mol-1。TNDPT分子中的较多硝基和稠环使得它具有很高的密度、爆速和爆压。
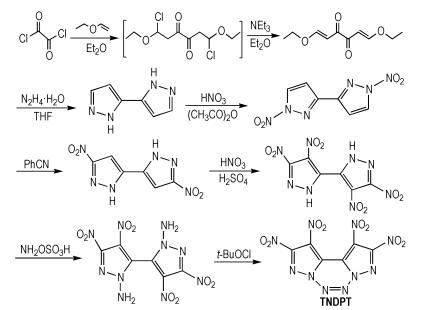
|
Scheme7 Synthesis of tetranitrodipyrazole annulated with 1, 2, 3, 4-tetrazine[15] |
Yin等[16]从3,6-二硝基吡唑基吡唑出发,以对甲基苯磺酰基-O-羟胺(TsONH2)为氨基化试剂,经过取代和硝化反应可以得到两个多硝基吡唑基吡唑(DNPPZ-1和DNPPZ-2),合成路线如Scheme 8所示。DNPPZ-1和DNPPZ-2的密度分别为1.93,1.95 g·cm-3,爆压分别为41.8,40.9 GPa,爆速分别为9.51,9.46 km·s-1,生成焓分别为595.2,550.9 kJ·mol-1。DNPPZ-1和DNPPZ-2分子骨架相似,都含有两个C-硝基;不同之处在于DNPPZ-1中含有N-硝胺基,而DNPPZ-2中含有N-硝基。两者相比,DNPPZ-2的密度较大,而DNPPZ-1的生成焓、爆速和爆压都较大,可见硝胺基有利于提高化合物的爆轰性能。
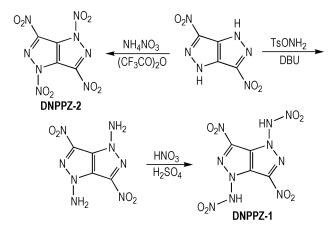
|
Scheme8 Synthesis of polynitropyrazolopyrazoles[16] |
殷欣等[17]通过3-硝基-1,2,4-三唑与溴代丙酮的取代反应,再经硝化反应得到1-三硝基甲基-3-硝基-1,2,4-三唑(TNMNT),合成路线如Scheme 9所示。TNMNT的密度为1.92 g·cm-3,爆压为35.5 GPa,爆速为9.02 km·s-1,生成焓为210.9 kJ·mol-1。TNMNT在低熔点弹药中有应用前景。

|
Scheme9 Synthesisof1-trinitromethyl-3-nitro-1, 2, 4-triazole [17] |
Kumar等[18]从5-氨基四唑衍生物出发,经过氧化、硝化和取代等反应,得到N-吡唑基-N′-四唑基乙烷(NPNTE),合成路线如Scheme 10所示。NPNTE的密度为1.84 g·cm-3,爆压为34.2 GPa,爆速为8.80 km·s-1,生成焓为501.8 kJ·mol-1。NPNTE分子中两个唑环通过碳-碳单键相连,所以分子柔性较好。
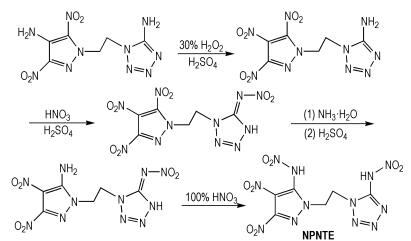
|
Scheme10 Synthesis of N-pyrazolyl‑N′-tetrazolyl ethane [18] |
在上述合成路线中,TNMANT和TNMNT的合成原料都可以商业上得到,而且反应步骤比较简单,容易操作,产率高,是一种较好的合成方法。TNDPT的合成步骤繁琐,产率低,所以有必要设计简单的合成路线。DNPPZ-1和DNPPZ-2的合成步骤简单,原料3,6-二硝基吡唑基吡唑虽然不能商业上得到,但是容易制备,综合考虑,可以对它们进行放大合成。NPNTE的合成步骤也较多,原料不能商业上得到,但是反应条件温和,每步产率较高。
2.3 五硝基富氮含能化合物Yin等[19]以商业上容易得到的吡唑为起始原料,经过取代、硝化和氧化等反应得到多硝基二吡唑并1,3,5-三氮杂环己烷(PNDPT),合成路线如Scheme 11所示。PNDPT的密度为1.94 g·cm-3,爆压为38.8 GPa,爆速为9.23 km · s-1,生成焓为521.3 kJ · mol-1。PNDPT分子中含有硝基和硝胺基,同时还是稠环化合物,所以其爆轰性能较好。另外,合成PNDPT过程中的多个中间体也可以作为含能材料[20]。

|
Scheme11 Synthesis of polynitro-functionalized dipyrazolo-1, 3, 5-triazinane[19] |
李亚南等[21]以3,5-二氨基-1,2,4-三唑为原料,通过1,3-二氯-2-硝基氮杂丙烷的N-烷基化反应得到N,N-双[(3,5-二硝基-1,2,4-三唑-1-基)甲基]硝胺(BDNTMN),合成路线如Scheme 12所示。BDNTMN的密度为1.95 g·cm-3,爆压为38.7 GPa,爆速为9.03 km·s-1,生成焓为425.0 kJ·mol-1,其爆轰性能优于RDX。
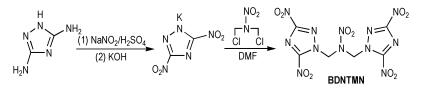
|
Scheme12 Synthesis of N, N-bis[(3, 5-dinitro-1, 2, 4-tri-azol-1-yl)methyl]nitramine[21] |
在以上合成方法中,PNDPT的合成原料容易得到,但是步骤多,产率低,成本高,所以未来可以改进其合成工艺。虽然BDNTMN的合成骤比较简单,但是主要原料3,5-二氨基-1,2,4-三唑和1,3-二氯-2-硝基氮杂丙烷都不能商业上得到。
2.4 六硝基富氮含能化合物Huang等[22]以Scheme 5中的中间体3,3′-二硝基-5,5′-二(1,2,4-三唑)和溴代丙酮为原料,经过硝化和氟代等反应得到5,5′-二硝基-3,3′-二(1,2,4-三唑)-2,2′-氟偕二硝基甲基(DNBTFM),合成路线如Scheme 13所示。DNBTFM的密度为1.93 g·cm-3,爆压为31.5 GPa,爆速为8.61 km·s-1,生成焓为64.6 kJ · mol-1。DNBTFM分子中含有氟偕二硝甲基。氟偕二硝甲基一种非常重要的新型高能量密度含能官能团,已应用于多种含能化合物的分子设计和合成中,含有该官能团的化合物大多具有较高的密度、较低的感度、较好的热稳定性和氧平衡以及良好的爆轰性能。
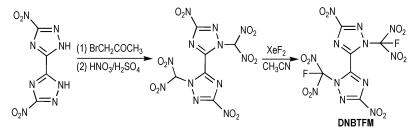
|
Scheme13 Synthesis of 5, 5′-dinitro-3, 3′-bis-1, 2, 4-tri-azole-2, 2′-fluorodinitromethyl [22] |
Yin等[23]以乙酸铵与乙二醛为原料,在三甲基苯磺酰基-O-羟胺(MSH)存在下发生N-氨基化反应,最后进行硝化反应得到四硝基二硝氨基双咪唑(TNMIZ),合成路线如Scheme 14所示。TNMIZ的密度为1.94 g·cm-3,爆压为40.1 GPa,爆速为9.35 km·s-1,生成焓为481.1 kJ·mol-1。从爆轰数据可以看出,TNMIZ的性能比较优良。TNMIZ属于多硝基咪唑含能化合物,其含能离子盐存在吸湿吸潮现象,因此此类化合物应尽量避免其离子盐形式。
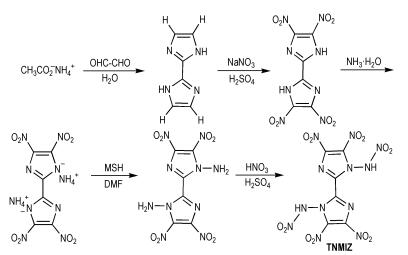
|
Scheme14 Synthesis of tetranitrodinitraminobiimidazole[23] |
Thottempudi等[24]以Scheme 6中的中间体氨基三唑基乙酸为原料,通过碱性条件下高锰酸钾氧化和硝化反应得到5,5′-二(三硝基甲基)-3,3′-偶氮-1,2,4-三唑(BTNMAT),合成路线如Scheme 15所示。BTNMAT的密度为1.83 g·cm-3,爆压为36.7 GPa,爆速为8.96 km·s-1,生成焓为555.1 kJ·mol-1。BTNMAT分子中也含有有利于提高化合物爆轰性能和稳定性的偶氮基。
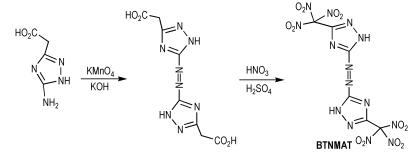
|
Scheme15 Synthesis of 5, 5′-bis(trinitromethyl)-3, 3′-azo-1, 2, 4-triazole[24] |
在DNBTFM、TNMIZ和BTNMAT分子中,虽然它们都含有六个硝基,但是生成焓差别较大,其中BTNMAT的生成焓最大,而DNBTFM的生成焓最小。BTNMAT的生成焓最高,主要是因为其分子内含有偶氮基,所以在设计合成含能化合物时要注意偶氮基的重要性。TNMIZ和BTNMAT的合成原料都可以商业上得到,而且反应容易操作,反应条件温和,同时,BTNMAT综合性能优良,可以进行放大合成。DNBTFM是一种新型含氟富氮含能化合物,合成步骤也比较简单,是一种较好的合成方法。
3 羟基氧富氮含能化合物羟基与具有共轭结构的唑环可以形成电子效应,从而提高化学键的键能,同时使富氮含能分子的稳定性提高,所以符合含能材料钝感的理念。羟基的存在可使富氮化合物形成分子内或分子间氢键,这些氢键也增强了化合物的稳定性。羟基上的氢具有一定酸性,容易以带负电荷的氧负离子形式存在,因此可以与其它阳离子结合形成含能金属盐和非金属盐。
Fischer等[25]以溴化氰和叠氮化钠为起始原料,通过环化、碱性氧化和酸化反应得到1,1′-二羟基-5,5′-偶氮双四唑(DDABT),合成路线如Scheme 16所示。DDABT的密度为1.90 g·cm-3,爆压为42.4 GPa,爆速为9.55 km·s-1,生成焓为883.2 kJ·mol-1。可以看出,DDABT的密度、爆压、爆速和生成焓都很高。
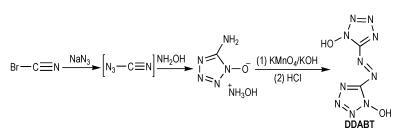
|
Scheme16 Synthesis of 1, 1′-dihydroxy-5, 5′-azobistetra-zole [25] |
Fischer等[26]还以叠氮化钠和氰化钠为原料,经过两次环化反应得到5-四唑基-1-羟基四唑(TZHT),合成路线如Scheme 17所示。TZHT的密度为1.76 g·cm-3,爆压为31.4 GPa,爆速为8.84 km·s-1,生成焓为636.6 kJ·mol-1。TZHT稳定性较差,可以转变为稳定性较好的羟胺、肼和胍盐等。
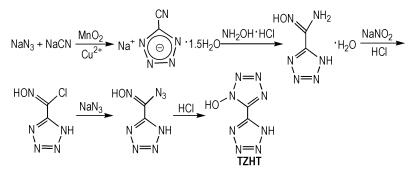
|
Scheme17 Synthesis of 5-tetrazolyl-1-hydroxytetrazole[26] |
Dippold等[27]以4,5-二氰基-1,2,3-三唑为原料,经过加成和取代等反应得到含有三个环的4,5-二[5-(1-羟基)四唑基]-1,2,3-三唑(BHTT),合成路线如Scheme 18所示。BHTT的密度为1.67 g · cm-3,爆压为26.0 GPa,爆速为8.23 km · s-1,生成焓为823.0 kJ·mol-1。通过数据可以看出,虽然BHTT生成焓很高,但是密度较低。

|
Scheme18 Synthesis of 4, 5-bis(1-hydroxytetrazol-5-yl)-1, 2, 3-triazole[27] |
以上羟基氧富氮含能化合物一般具有以下几个特点:(1)具有较高的生成焓,特别是DDABT;(2)合成步骤比较简单,原料易得,成本低;(3)由于羟基氢比较活泼,共价型分子容易与羟胺、肼和胍等反应生成相应的盐;(4)TZHT和BHTT密度偏低。为了提高TZHT和BHTT的密度,可以在它们分子中引入偶氮基和稠环等。在上述合成方法中,DDABT的合成步骤简单,原料易得,反应条件温和,且分子中含有偶氮基,因为偶氮基既可以提高富氮化合物爆轰性能,又能增强化合物的稳定性,所以可以开展其放大合成工作。TZHT的合成步骤较少,容易操作,反应条件温和,各种原料易得,也是一种较好的合成路线。BHTT的合成步骤简单,虽然起始原料4,5-二氰基-1,2,3-三唑不能商业上得到,但是容易制备。目前关于羟基氧富氮化合物的合成报道较少,未来可以加强这类化合物的合成及其性能研究。
4 配位氧富氮含能化合物在富氮化合物中引入配位氧基团即N→O键,既可以进一步提高其密度,增强爆轰性能,改善感度,提高氧平衡,而且有助于稳定整个分子。
Voronin等[28]从2,2-二(叔丁基-NNO-氧化偶氮基)乙腈出发,经过多步反应得到四嗪并四嗪-1,3,6,8-四氧化物(TTTO),合成路线如Scheme 19所示。TTTO的密度为1.98 g·cm-3,爆压为43.2 GPa,爆速为9.71 km·s-1,生成焓为861.1 kJ·mol-1。可以看出,TTTO的密度、爆压、爆速和生成焓都非常高,可见,配位氧和稠环有利于提高化合物的爆轰性能。
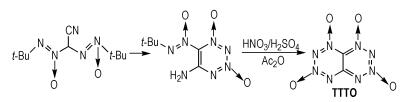
|
Scheme19 Synthesis of tetrazine annulated with tetrazine-1, 3, 6, 8-tetraoxide[28] |
Klenov等[29]以二氮杂二环(DBU)为催化剂,(叔丁基-NNO-氧化偶氮基)乙腈和芳香叠氮化物为原料,通过硝化反应得到1,2,3,4-四嗪-1,3-二氧化物并1,2,3-三唑(TZDOT),合成路线如Scheme 20所示。TZDOT的密度为1.94 g·cm-3,其它爆轰数据没有报道,所以需要对其做进一步研究。
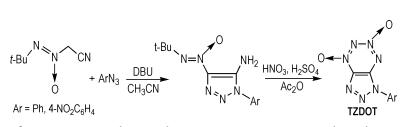
|
Scheme20 Synthesis of 1, 2, 3, 4-tetrazine-1, 3-dioxide an-nulated with 1, 2, 3-triazole[29] |
Chavez等[30]从3-氨基-6叠氮基-1,2,4,5-四嗪出发,在乙腈中以过氧三氟乙酸(PTFA)为氧化剂,然后以次氟酸为氧化剂,得到四唑并1,2,4,5-四嗪-N-氧化物(TZTZO),合成路线如Scheme 21所示。TZTZO的密度为1.93 g·cm-3,爆压为41.3 GPa,爆速为9.60 km·s-1,生成焓为576.0 kJ·mol-1。TZTZO分子中的氨基有利于改善化合物的稳定性和感度。
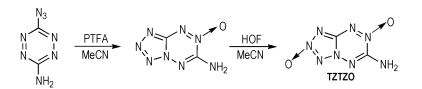
|
Scheme21 Synthesisof tetrazolo 1, 2, 4, 5-tetrazine-N-oxide [30] |
上述三个配位氧富氮含能化合物的分子骨架都含有四嗪环,而嗪类化合物比唑类具有较好的热稳定性。同时,三个化合物都含有稠环,具有高密度的天然优势。在TTTO合成中,起始原料的合成工艺非常复杂,成本高,且TTTO的总产率只有1%,所以该法不具有实用价值,但是该反应提供了一种通过分之内环化反应构建稠环四嗪含能骨架的方法,未来可以进行其工艺改进研究。TZDOT分子内含有苯环,导致了其含氮量较低,且起始原料不能商业上得到,价格贵,合成难度大。TZTZO的合成步骤比较简单,原料3-氨基-6叠氮基-1,2,4,5-四嗪虽然无法从商业上得到,但是容易制备。
5 羰基氧富氮含能化合物在具有相同类型的母环结构的化合物内部,羰基可以提高密度,这是由于含不饱和键的羰基可以使环的刚性增加从而更紧凑。羰基的α位上N原子上的电子密度较小,硝化难度较大。羰基化合物的生成焓明显比同样结构的其它分子低,羰基化合物一定程度上降低了结构的能量,不过这对提高分子稳定性有一定的帮助。
Yin等[31]以苯甲醛和肼为起始原料,经过亲核加成和环化等反应得到1-氨基四唑-5-酮(ATO),合成路线如Scheme 22所示。ATO的密度为1.79 g·cm-3,爆压为35.0 GPa,爆速为8.88 km · s-1,生成焓为342.9 kJ·mol-1,冲击感大于40 J。ATO分子内含有氨基,而氨基有利于降低感度和降低分子的能量,所以ATO的稳定性较好。
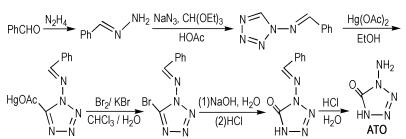
|
Scheme22 Synthesis of 1-aminotetrazole-5-one[31] |
Qin等[32]以二氨基马来腈为原料,经过两次环化反应得到4-甲酰胺-5-(四唑-5-基)-1,2,3-三唑(CTT),合成路线如Scheme 23所示。CTT的密度为1.67 g·cm-3,爆压为21.9 GPa,爆速为7.18 km·s-1,生成焓为537.8 kJ·mol-1,摩擦感度大于360 N(BAM试验),冲击感度大于40 J,所以CTT是一种钝感含能化合物。
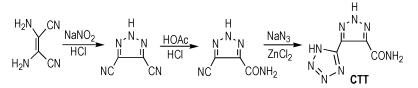
|
Scheme23 Synthesis of 4-carboxamide-5(-tetrazol-5-yl)-1, 2, 3-triazole[32] |
Liu等[33]以4-氨基-1,2,4-三唑为主要原料,二氯异氰尿酸钠(SDIC)或高锰酸钾为氧化剂,得到3,3′-二酮-4,4′-偶氮-1,2,4-三唑(DAT),其合成路线如Scheme 24所示。DAT的密度为1.62 g·cm-3,爆压为19.2 GPa,爆速为7.47 km·s-1,生成焓为344.0 kJ·mol-1,摩擦感度>360 N(BAM试验),冲击感度>40 J,所以DAT也是一种钝感含能化合物。DAT分子中含有的偶氮基可以提高化合物的含氮量和生成焓,并增加稳定性,但由于其分子中还存在两个甲基,所以导致分子整体含氮量较低。
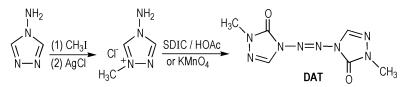
|
Scheme24 Synthesis of 3, 3′-dione-4, 4′-azo-1, 2, 4-tri-azole [33] |
从以上数据可以看出,羰基氧富氮含能化合物的密度都较小,但是摩擦感度和冲击感度都很好。在以上合成方法中,ATO的合成步骤较多,但所需原料都容易得到,总产率较高。CTT和DAT的合成步骤都比较简单,容易操作,反应条件温和,原料易得,总产率也较高,所以具有潜在的应用前景,都是比较好的合成方法,可以进行放大合成。另外,羰基是一个不饱和基团,由于羰基氧原子的电负性比碳原子大,且由于π电子的流动性较大,所以羰基氧富氮化合物是极性较强的分子,使得该类分子极易发生亲核加成反应,从而生成一系列衍生物。
6 复合氧富氮含能化合物复合氧富氮含能化合物融合了氧的不同类型,它含有两种或两种以上氧的类型,其氧常以前述的硝基氧、羟基氧、羰基氧和配位氧以及醚氧和杂环氧等形式存在。这类化合物的合成也是近几年含能材料的研究热点之一。复合氧富氮化合物一般也具有良好的爆轰性能,已成为含能材料领域的一个重要研究方向。
6.1 硝基氧-杂环氧富氮含能化合物Yu等[34]从1,3,4-噁二唑基-2,5-二乙酸乙酯出发,经过硝化和脱羧等反应得到2,5-二(三硝基甲基)-1,3,4-噁二唑(BTNMO),合成路线如Scheme 25所示。BTNMO的密度为1.92 g·cm-3,爆压为29.2 GPa,爆速为8.23 km·s-1,生成焓为29.4 kJ·mol-1。可以看出,BTNMO的生成焓较低,这主要是因为其分子中含有两个硝仿基,而硝仿基会导致化合物的生成焓降低。
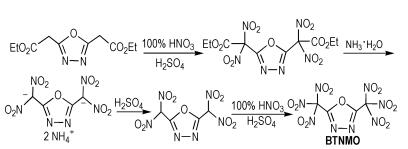
|
Scheme25 Synthesis of 2, 5-bis (trinitromethyl)-1, 3, 4-oxa-diazole[34] |
Tang等[35]以商业可以得到的3-乙氧基-3-亚氨基丙酸乙酯盐酸盐为原料,经过取代、氧化和硝化等反应得到5,5′-二硝基甲基-3,3′-偶氮-1,2,4-噁二唑(DNMAO),合成路线如Scheme 26所示。DNMAO的密度为1.81 g · cm-3,爆压为33.2 GPa,爆速为8.76 km·s-1,生成焓为332.9 kJ·mol-1。由于两个硝基的强吸电子作用,使得DNMAO分子中偕二硝基甲基碳原子上的氢具有酸性,从而可以构建含能离子盐。
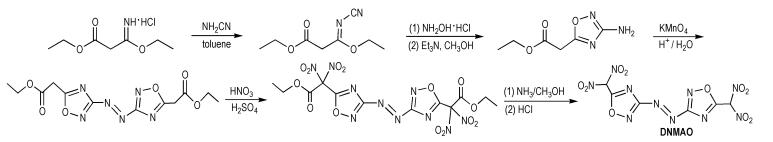
|
Scheme26 Synthesis of 5, 5′-dinitromethyl-3, 3′-azo-1, 2, 4-oxadiazole[35] |
Tang等[36]又以二氰胺钠为原料,通过环化和硝化等反应,得到3-氨基-5-硝胺基-1,2,4-噁二唑(ANAO),合成路线如Scheme 27所示。ANAO的密度为1.70 g·cm-3,爆压为25.6 GPa,爆速为8.03 km·s-1,生成焓为251.6 kJ·mol-1,摩擦感度大于360 N(BAM试验),冲击感度大于40 J。ANAO分子中的氨基有利于增强化合物的稳定性。由于硝胺基含有酸性氢,所以ANAO容易与氨水或羟胺反应反应得到相应的盐。
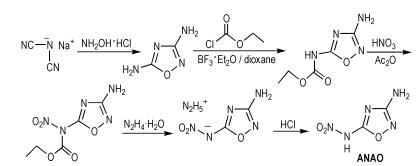
|
Scheme27 Synthesis of 3-amino-5-nitramino-1, 2, 4-oxadi-azole [36] |
Kettner等[37]以二氨基乙二醛肟和丙二酸二乙酯为原料,经过环化和硝化等反应得到5,5′-二(三硝基甲基)-3,3′-二(1,2,4-噁二唑)(BTNMBO),合成路线如Scheme 28所示。BTNMBO的密度为1.94 g·cm-3,爆压为34.5 GPa,爆速为8.81 km·s-1,生成焓为61.9 kJ·mol-1。由于BTNMBO分子中含有两个硝仿基,所以其生成焓较小。
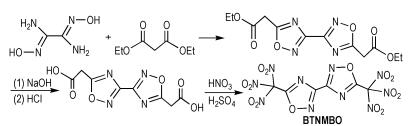
|
Scheme28 Synthesis of 5, 5′-bis(trinitromethyl)-3, 3′-bi (1, 2, 4-oxadiazole) [37] |
Hermann等[38]以乙二酰肼和溴化氰为原料,经过环化反应后,再用100%硝酸硝化得到2,2′-二硝胺基-5,5′-二(1,3,4-噁二唑)(DNABO),合成路线如Scheme 29所示。DNABO的密度为1.98 g · cm-3,爆压为39.1 GPa,爆速为9.39 km · s-1,生成焓为278.6 kJ·mol-1。可以看出,DNABO的密度很高。另外,因为两个硝胺基上都有活泼氢,所以DNABO也很容易转变为铵盐、羟胺盐和胍盐等。
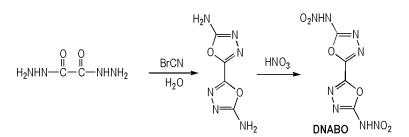
|
Scheme29 Synthesis of 2, 2′-dinitramino-5, 5′-bi(1, 3, 4-oxadiazole) [38] |
Tian等[39]以氰基乙酸乙酯和乙醇为原料,经过环化和硝化等反应得到5,5′-二(三硝基甲基)-2,2′-二(1,3,4-噁二唑)(BTBO),合成路线如Scheme 30所示。BTBO的密度为1.90 g·cm-3,爆压为33.2 GPa,爆速为8.76 km·s-1,生成焓为231.0 kJ·mol-1。
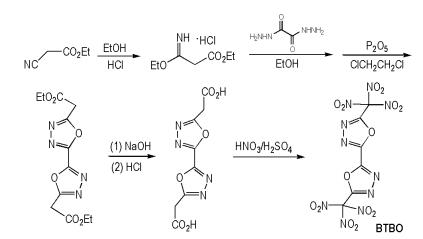
|
Scheme30 Synthesis of 5, 5′-bis(trinitromethyl)-2, 2′-bi (1, 3, 4-oxadiazole) [39] |
硝基氧-杂环氧富氮含能化合物的主要骨架为1,2,4-噁二唑和1,3,4-噁二唑。噁二唑类化合物的总体能量水平低、感度低,但在其侧链上引入高能化学基团硝基后,可显著提高噁二唑类化合物的能量密度,因此噁二唑类化合物的性能还有较大的提升空间。噁二唑环为平面结构,有利于分子的空间紧密排布,因此噁二唑类含能化合物具有较高的密度。噁二唑环具有芳香性,可有效降低分子的偶极距,即使在支链上引入硝仿基和偕二硝基等高极性基团,也能保持较低感度。BTNMO、BTNMBO和BTBO分子中都含有硝仿基,生成焓都较低,所以需要对它们分子进行修饰,可以在噁二唑骨架上引进偶氮基和硝胺基等,从而提高它们生成焓。
在以上合成方法中,DNMAO和BTBO的合成步骤都较多,但是原料都可以商业上得到;DNMAO分子中含有偶氮基,稳定性较好,爆轰性能优良,所以未来可以设计其简单合成工艺。BTNMO、ANAO、BTNMBO和DNABO的合成工艺都比较简单,操作方便,反应条件温和,原料都容易得到,所以都是较好的合成路线,可以对该它们进行放大合成。
6.2 其它复合氧富氮含能化合物Chavez等[40]以2-氟-2,2-二硝基乙醇(FDNE)和3,6-二氯-1,2,4,5-四嗪为原料,在4(-N,N-二甲基氨基)吡啶(DMAP)存在下,得到1,2,4,5-四嗪-N-氧化物氟偕二硝基乙醚(FET),合成路线如Scheme 31所示。FET的密度为1.96 g·cm-3,爆压为40.6 GPa,爆速为8.80 km·s-1,生成焓为322.0 kJ·mol-1。FET分子中含有硝基氧、醚氧和配位氧。醚氧的引入会增加分子的柔韧性和稳定性,同时,含有醚氧的化合物通常还具有熔点较低和增塑性强等特点。

|
Scheme31 Synthesis of fluorodinitroethoxy 1, 2, 4, 5-tetra-zine-N-oxide[40] |
Yan等[41]以乙二醛为原料,经过肟化和环化等反应得到5-(1,2,4-噁二唑基-3-基)-1-羟基四唑(OHT),合成路线如Scheme 32所示。OHT的密度为1.69 g·cm-3,爆压为25.0 GPa,爆速为8.04 km·s-1,生成焓为363.0 kJ·mol-1。OHT分子中含有杂环氧和羟基氧,由于羟基氢具有一定的酸性,所以在碱性条件下,OHT可以与氨水、羟胺和肼等反应生成相应的盐。

|
Scheme32 Synthesis of 5-(1, 2, 4-oxadiazolyl-3-yl)-1-hy-droxytetrazole[41] |
Yu等[42]以1,3,4-噁二唑基二乙酸乙酯为原料,经过硝化等反应得到二[5-(2-三硝基甲基)-1,3,4-噁二唑基]甲酮(TNMOM),合成路线如Scheme 33所示。TNMOM的密度为1.89 g·cm-3,爆压为32.7 GPa,爆速为8.67 km·s-1,生成焓为60.3 kJ·mol-1。TNMOM分子中氧的类型也较多,有硝基氧、杂环氧和羰基氧。
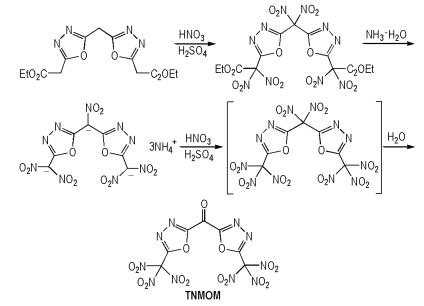
|
Scheme33 Synthesis of bis(2-trinitromethyl-1, 3, 4-oxadia-zole-5-yl) methanone[42] |
Piercey等[43]从3-硝基-5-氨基-1,2,4-三唑[44]出发,经过重氮化和环化等反应合成得到三唑并1,2,4-三嗪N‑氧化物(TTNO),合成路线如Scheme 34所示。TTNO的密度为1.90 g·cm-3,爆压为35.4 GPa,爆速为8.97 km·s-1,生成焓为378.0 kJ·mol-1。TTNO中的氨基对分子的安全性有积极的改善作用。
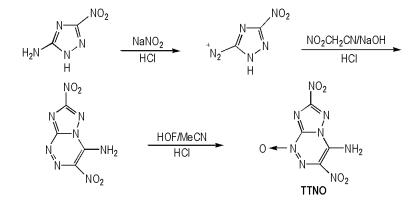
|
Scheme34 Synthesis of triazolo-1, 2, 4-triazine-N-oxide[43] |
在上述合成方法中,FET的合成步骤比较简单,原料都可以商业上得到。OHT的合成原料也可以商业上得到,且价格比较便宜,但是反应步骤较多。TNMOM和TTNO的合成步骤都比较简单,容易操作,但起始原料都不能商业上得到。总的来看,FET、OHT和TTNO的合成原料易得或者原料易于制备,所以可以开展它们的放大合成研究。
7 总结与展望综述了共价型含氧富氮含能化合物(唑类和嗪类)的合成方法,并对含氧富氮含能化合物的性能进行了介绍。目前,美国爱达荷大学和德国慕尼黑大学以及国内北京理工大学、南京理工大学、西安近代化学研究所以及中国工程物理研究院化工材料研究所等单位对含氧富氮含能化合物合成研究报道较多。
上述含氧富氮化合物大多具有较高的密度和生成焓以及良好的氧平衡,而提高富氮化合物的密度和生成焓一般能够提高其爆轰性能。通过比较可以发现,各类含氧富氮含能化合物的性能参数各有优缺点。硝基氧富氮含能化合物和复合氧富氮含能化合物的合成研究最为活跃,其化合物数目众多,大多具有较高的密度和生成焓,爆轰性能较好;羟基氧富氮含能化合物一般具有很高的生成焓,但是密度偏低;配位氧富氮含能化合物的密度都很高,同时也具有较好的爆轰性能;羰基氧富氮含能化合物都具有很好的摩擦感度和冲击感度,但是密度也偏低。对于密度和生成焓较低的化合物,可以在分子中引入偶氮基、硝胺基和稠环等。
事实上,由共价型含氧富氮含能分子还可以衍生为许多金属和非金属盐类化合物[45-48],所以含氧富氮含能化合物的涉及范围很广。另外,有些含氧富氮含能化合物属于无氢化合物[49],具有潜在的应用前景,比如TAT(Scheme 5)、TNDPT(Scheme 7)、TTTO(Scheme 19)、BTBO(Scheme 30)和TNMOM(Scheme 33)等;但是,通过数据可以看出,这些无氢富氮含能化合物的生成焓并不高,所以需要对它们进行分子结构修饰,引入有利于提高生成焓的基团。
虽然文献报道的含氧富氮含能化合物的合成方法很多,但仍有一些方向需要探索和研究。笔者认为未来应当注意以下几个方面的研究:
(1)对合成工艺简单、原料易得的优异含氧富氮含能化合物进行放大合成和实际应用研究,比如化合物DNTAT(Scheme 2)和TZBTZ(Scheme 4)等。
(2)对合成难度大、成本高的优异含氧富氮含能化合物进行工艺改进,比如化合物TNDPT(Scheme 7)和TTTO(Scheme 19)等。
(3)设计新型含氧富氮含能化合物时,最好引入偶氮基和稠环,因为偶氮基不仅可以明显提高富氮化合物的含氮量以及生成焓、密度、爆速和爆压,而且偶氮基的共轭结构能增加整个分子的稳定性、改善熔点;以富氮稠环作为含能材料的分子骨架是提高密度的重要途径,这是因为相比其单环类似物,稠环化合物更刚性,所以密度也更高;此外,稠环骨架的环张力更大,提高了化合物的生成焓,增强了含能材料的综合性能。
(4)近年来,随着人们环保意识的提高和绿色化学的兴起,环境友好合成已成为当前化工生产的主流,所以要特别注重工业化生产的要求,遵循绿色理念,研发一些低毒、廉价、高效的合成路线,并期望具有优异特性的含氧富氮含能化合物能在实际中得到真正的应用。
| [1] |
Zhang C, Sun C, Hu B, et al. Synthesis and characterization of the pentazolate anion cyclo-N5- in (N5)6(H3O)3(NH4)4Cl[J].
Science, 2017, 355(6323): 374-376. DOI:10.1126/science.aah3840 |
| [2] |
Xu Y, Wang Q, Shen C, et al. A series of energetic metal pentazolate hydrates[J].
Nature, 2017, 549(7670): 78-81. DOI:10.1038/nature23662 |
| [3] |
Yin P, Zhang Q, Shreeve J M. Dancing with energetic nitrogen atoms:versatile N-functionalization strategies for N-heterocyclic frameworks in high energy density materials[J].
Accounts of Chemical Research, 2016, 49(1): 4-16. DOI:10.1021/acs.accounts.5b00477 |
| [4] |
周阳, 龙新平, 王欣, 等. 高氮含能化合物的研究新进展[J].
含能材料, 2006, 14(4): 315-320. ZHOU Yang, LONG Xin-ping, WANG Xin, et al. Review on high-nitrogen energetic materials[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2006, 14(4): 315-320. |
| [5] |
Steinhauser G, Klapötke T M. "Green"pyrotechnics:a chemists′ challenge[J].
Angewandte Chemie International Edition, 2008, 47(18): 3330-3347. DOI:10.1002/(ISSN)1521-3773 |
| [6] |
岳守体, 阳世清. 3, 6-双(1-氢-1, 2, 3, 4-四唑-5-氨基)-1, 2, 4, 5四嗪的合成及其性能[J].
含能材料, 2004, 12(3): 155-157. YUE Sou-ti, YANG Shi-qing. Synthesis and properties of 3, 6-bis(1H-1, 2, 3, 4-tetrazol-5-yl-amino)-1, 2, 4, 5-tetrazine[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2004, 12(3): 155-157. |
| [7] |
Huynh M V, Hiskey M A, Hartline E L, et al. Polyazido highnitrogen compounds:hydrazo-and azo-1, 3, 5-triazine[J].
Angewandte Chemie International Edition, 2004, 43(37): 4924-4928. DOI:10.1002/(ISSN)1521-3773 |
| [8] |
Chen D, Yang H, Yi Z, et al. C8N26H4:an environmentally friendly primary explosive with high heat of formation[J].
Angewandte Chemie International Edition, 2018, 57(8): 2081-2084. DOI:10.1002/anie.v57.8 |
| [9] |
Fischer D, Klapötke T M, Stierstorfer J. 1, 5-Di(nitramino)tetrazole: high sensitivity and superior explosive performance[J].
Angewandte Chemie International Edition, 2015, 54(35): 10299-10302. DOI:10.1002/anie.201502919 |
| [10] |
Dippold A, Klapötke T M, Martin F A. Synthesis and characterization of bis(triaminoguanidinium)5, 5′-dinitrimino-3, 3′ azo-1H-1, 2, 4-triazolate-a novel insensitive energetic material[J].
Zeitschrift für Anorganische und Allgemeine Chemie, 2011, 637(9): 1181-1193. DOI:10.1002/zaac.v637.9 |
| [11] |
Fu W, Zhao B, Zhang M, et al. 3, 4-Dinitro-1-(1H-tetrazol-5yl)-1H-pyrazol-5-amine(HANTP)and its salts:primary and secondary explosives[J].
Journal of Materials Chemistry A, 2017, 5(10): 5044-5054. DOI:10.1039/C6TA08376E |
| [12] |
Shlomovich A, Pechersky T, Cohen A, et al. Energetic isomers of 1, 2, 4, 5-tetrazine-bis-1, 2, 4-triazoles with low toxicity[J].
Dalton Transactions, 2017, 46(18): 5994-6002. DOI:10.1039/C7DT00935F |
| [13] |
Chavez D E, Bottaro J C, Petrie M, et al. Synthesis and thermal behavior of a fused, tricyclic 1, 2, 3, 4-tetrazine ring system[J].
Angewandte Chemie International Edition, 2015, 54(44): 12973-12975. DOI:10.1002/anie.201506744 |
| [14] |
Hermann T S, Klapötke T M, Krumm B, et al. The energetic 3trinitromethyl-5-nitramino-1H-1, 2, 4-triazole and nitrogen rich salts[J].
New Journal of Chemistry, 2017, 41(8): 3068-3072. DOI:10.1039/C7NJ00695K |
| [15] |
Tang Y, Kumar D, Shreeve J M. Balancing excellent performance and high thermal stability in a dinitropyrazole fused 1, 2, 3, 4-tetrazine[J].
Journal of the American Chemical Society, 2017, 139(39): 13684-13687. DOI:10.1021/jacs.7b08789 |
| [16] |
Yin P, Zhang J, Mitchell L A, et al. 3, 6-Dinitropyrazolo[4, 3-c] pyrazole-based multipurpose energetic materials through versatile N-functionalization strategies[J].
Angewandte Chemie International Edition, 2016, 55(41): 12895-12897. DOI:10.1002/anie.201606894 |
| [17] |
殷欣, 马卿, 王军, 等. 1-三硝甲基-3-硝基-1, 2, 4-三唑的晶体结构及性能预估[J].
含能材料, 2017, 25(5): 437-440. YIN Xin, MA Qing, WANG Jun, et al. Crystal structure and property prediction of 1-trinitromethyl-3-nitro-1, 2, 4-triazole[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2017, 25(5): 437-440. DOI:10.11943/j.issn.1006-9941.2017.05.014 |
| [18] |
Kumar D, Imler G H, Parrish D A, et al. Resolving synthetic challenges faced in the syntheses of asymmetric N, N′-ethylene-bridged energetic compounds[J].
New Journal of Chemistry, 2017, 41(10): 4040-4047. DOI:10.1039/C7NJ00327G |
| [19] |
Yin P, Zhang J, Imler G H, et al. Polynitro-functionalized dipyrazolo-1, 3, 5-triazinanes:energetic polycyclization toward high density and excellent molecular stability[J].
Angewandte Chemie International Edition, 2017, 56(30): 8834-8838. DOI:10.1002/anie.v56.30 |
| [20] |
Fischer D, Gottfried J L, Klapötke T M, et al. Synthesis and investigation of advanced energetic materials based on bispyrazolylmethanes[J].
Angewandte Chemie International Edition, 2016, 55(52): 16132-16135. DOI:10.1002/anie.201609267 |
| [21] |
LI Ya-nan, WU Min-jie, ZHANG Sheng-yong, et al. Synthesis and properties of N, N-bis ((3, 5-dinitro-1H-1, 2, 4-triazol-1-yl) methyl) nitramine[J].
Chinese Journal of Energetic Materials (Hanneng Cailiao), 2015, 23(12): 1167-1171. |
| [22] |
Huang S, Tian J, Qi X, et al. Synthesis of gem-dinitromethylated and fluorodinitromethylated derivatives of 5, 5′-dinitro-bis-1, 2, 4-triazole as promising high-energy-density materials[J].
Chemistry-A European Journal, 2017, 23(52): 12787-12794. DOI:10.1002/chem.v23.52 |
| [23] |
Yin P, Shreeve J M. From N-nitro to N-nitroamino:preparation of high-performance energetic materials by introducing nitrogen-containing ions[J].
Angewandte Chemie International Edition, 2015, 54(48): 14513-14517. DOI:10.1002/anie.201507456 |
| [24] |
Thottempudi V, Gao H, Shreeve J M. Trinitromethyl-substituted 5-nitro-or 3-azo-1, 2, 4-triazoles:synthesis, characterization, and energetic properties[J].
Journal of the American Chemical Society, 2011, 133(16): 6464-6471. DOI:10.1021/ja2013455 |
| [25] |
Fischer D, Klapötke T M, Piercey D G, et al. Synthesis of 5 aminotetrazole-1N-oxide and its azo derivative:a key step in the development of new energetic materials[J].
Chemistry-A European Journal, 2013, 19(14): 4602-4613. DOI:10.1002/chem.201203493 |
| [26] |
Fischer D, Klapötke T M, Reymann M, et al. Synthesis of 5(1H-tetrazolyl)-1-hydroxy-tetrazole and energetically relevant nitrogen-rich ionic derivatives[J].
Propellants, Explosives, Pyrotechnics, 2014, 39(4): 550-557. DOI:10.1002/prep.201300152 |
| [27] |
Dippold A A, Izsak D, Klapoötke T M, et al. Combining the advantages of tetrazoles and 1, 2, 3-triazoles:4, 5-bis(tetrazol-5yl)-1, 2, 3-triazole, 4, 5-bis(1-hydroxytetrazol-5-yl)-1, 2, 3-triazole, and their energetic derivatives[J].
Chemistry-A European Journal, 2016, 22(5): 1768-1778. DOI:10.1002/chem.201504624 |
| [28] |
Voronin A A, Churakov A M, Klenov M S, et al. Synthesis of 1, 2, 3, 4-tetrazine 1, 3-dioxides annulated with 1(2)-aryl-1, 2, 3-triazoles[J].
European Journal of Organic Chemistry, 2017(33): 4963-4971. |
| [29] |
Klenov M S, Guskov A A, Anikin O V, et al. Synthesis of tetrazino-tetrazine 1, 3, 6, 8-tetraoxide(TTTO)[J].
Angewandte Chemie International Edition, 2016, 55(38): 11472-11475. DOI:10.1002/anie.201605611 |
| [30] |
Chavez D E, Parrish D A, Mitchell L, et al. Azido and tetrazolo 1, 2, 4, 5-tetrazine N-oxides[J].
Angewandte Chemie International Edition, 2017, 56(13): 3575-3578. DOI:10.1002/anie.201612496 |
| [31] |
Yin X, Wu J T, Jin X, et al. Nitrogen-rich salts of 1-aminotetrazol-5-one:oxygen-containing insensitive energetic materials with high thermal stability[J].
RSC Advances, 2015, 5(74): 60005-60014. DOI:10.1039/C5RA07649H |
| [32] |
Qin J, Li T, Zhang J G, et al. The nitrogen-rich energetic compound 4-carboxamide-5-(1H-tetrazol-5-yl)-1H-1, 2, 3-triazole and its 1D sodium complex:synthesis and properties[J].
RSC Advances, 2016, 6(103): 101430-101436. DOI:10.1039/C6RA22151C |
| [33] |
Liu W, Li S H, Li Y C, et al. Nitrogen-rich salts based on polyamino substituted N, N ′-azo-1, 2, 4-triazole:a new family of high-performance energetic materials[J].
Journal of Materials Chemistry A, 2014, 2(38): 15978-15986. DOI:10.1039/C4TA03016H |
| [34] |
Yu Q, Yin P, Zhang J, et al. Pushing the limits of oxygen balance in 1, 3, 4-oxadiazoles[J].
Journal of the American Chemical Society, 2017, 139(26): 8816-8819. DOI:10.1021/jacs.7b05158 |
| [35] |
Tang Y, He C, Imler G H, et al. Dinitromethyl-3(5)-1, 2, 4oxadiazole derivatives from controllable cyclization strategies[J].
Chemistry-A European Journal, 2017, 23(64): 16401-16407. DOI:10.1002/chem.v23.64 |
| [36] |
Tang Y, Gao H, Mitchell L A, et al. Enhancing energetic properties and sensitivity by incorporating amino and nitramino groups into a 1, 2, 4-oxadiazole building block[J].
Angewandte Chemie International Edition, 2016, 55(3): 1147-1150. DOI:10.1002/anie.201509985 |
| [37] |
Kettner M A, Karaghiosoff K, Klapötke T M, et al. 3, 3′-Bi (1, 2, 4-oxadiazoles) featuring the fluorodinitromethyl and trinitromethyl groups[J].
Chemistry-A European Journal, 2014, 20(25): 7622-7631. DOI:10.1002/chem.201402291 |
| [38] |
Hermann T S, Karaghiosoff K, Klapötke T M, et al. Synthesis and characterization of 2, 2′-dinitramino-5, 5′-bi (1-oxa-3, 4-diazole)and derivatives as economic and highly dense energetic materials[J].
Chemistry-A European Journal, 2017, 23(50): 12087-12091. DOI:10.1002/chem.201702191 |
| [39] |
Tian J, Xiong H, Lin Q, et al. Energetic compounds featuring bi (1, 3, 4-oxadiazole):a new family of insensitive energetic materials[J].
New Journal of Chemistry, 2017, 41(5): 1918-1924. DOI:10.1039/C6NJ03608B |
| [40] |
Chavez D E, Parrish D A, Mitchell L. Energetic trinitro-and fluorodinitroethyl ethers of 1, 2, 4, 5-tetrazines[J].
Angewandte Chemie International Edition, 2016, 55(30): 8666-8669. DOI:10.1002/anie.201604115 |
| [41] |
Yan C, Wang K, Liu T, et al. Exploiting the energetic potential of 1, 2, 4-oxadiazole derivatives:combining the benefits of a 1, 2, 4-oxadiazole framework with various energetic functionalities[J].
Dalton Transactions, 2017, 46(41): 14210-14218. DOI:10.1039/C7DT03320F |
| [42] |
Yu Q, Imler G H, Parrish D A, et al. Nitromethane bridged bis (1, 3, 4-oxadiazoles):trianionic energetic salts with low sensitivities[J].
Chemistry-A European Journal, 2017, 23(70): 17682-17686. DOI:10.1002/chem.v23.70 |
| [43] |
Piercey D G, Chavez D E, Scott B L, et al. An energetic triazolo-1, 2, 4-triazine and its N-oxide[J].
Angewandte Chemie International Edition, 2016, 55(49): 15315-15318. DOI:10.1002/anie.v55.49 |
| [44] |
Zhao X X, Zhang J C, Li S H, et al. A green and facile approach for synthesis of nitro heteroaromatics in water[J].
Organic Process Research & Development, 2014, 18(7): 886-890. |
| [45] |
Zhang J, Dharavath S, Mitchell L A, et al. Energetic salts based on 3, 5-bis(dinitromethyl)-1, 2, 4-triazole monoanion and dianion:controllable preparation, characterization, and high performance[J].
Journal of the American Chemical Society, 2016, 138(24): 7500-7503. DOI:10.1021/jacs.6b03819 |
| [46] |
Dharavath S, Zhang J, Imler G H, et al. 5-(Dinitromethyl)-3(trinitromethyl)-1, 2, 4-triazole and its derivatives:a new application of oxidative nitration towards gem-trinitro-based energetic materials[J].
Journal of Materials Chemistry A, 2017, 5(10): 4785-4790. DOI:10.1039/C7TA00730B |
| [47] |
Szimhardt N, Bölter M F, Born M, et al. Metal salts and complexes of 1, 1′-dinitramino-5, 5′-bitetrazole[J].
Dalton Transactions, 2017, 46(15): 5033-5040. DOI:10.1039/C7DT00536A |
| [48] |
He P, Wu L, Wu J, et al. Green energetic nitrogen-rich salts of 1, 1′-dinitramino-5, 5′-bistetrazolate[J].
Chemistry-A European Journal, 2017, 23(46): 11159-11168. DOI:10.1002/chem.201702759 |
| [49] |
张英豪, 杜志明, 韩志跃, 等. 无氢富氮含能化合物的研究进展[J].
含能材料, 2015, 23(5): 496-503. ZHANG Ying-hao, DU Zhi-ming, HAN Zhi-yue, et al. Review on nitrogen-rich compounds without hydrogen[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2015, 23(5): 496-503. DOI:10.11943/j.issn.1006-9941.2015.05.017 |
Nitrogen-rich energetic compounds containing oxygen have attracted great attention due to their excellent features such as high percentage of nitrogen, low carbon and hydrogen content, good oxygen balance and high enthalpy of formation.They have an optimistic and bright foreground for applying to the fields of high energetic explosive, pyrotechnics and solid rocket prop




