硝仿肼(Hydrazinium nitroformate, HNF)为三硝基甲烷(硝仿, NF)与肼反应所生成的盐, 一般为橙黄色结晶, 属于单斜晶系[1]。自20世纪80年代以来, HNF作为火箭推进剂的氧化剂迅速发展[2]。荷兰、美国、日本等近些年都报道了安全制备硝仿和HNF的生产新工艺, 荷兰还成功开发了小批量连续化生产高纯度、不同粒径HNF的新技术[3]。另外, HNF有比高氯酸铵(AP)更高的比冲与更低的热感度[4], 被视为推进剂的重要组成部分。更重要的是, HNF中不含氯元素[4], 具有无烟, 对环境无污染等环境友好性能。
国内外学者对HNF热分解过程进行了大量的研究[4-5], 其中Williams和Brill[5]在25~400 ℃温度范围内采用T-Jump/FTIR光谱法对HNF的燃烧过程进行了分析。在125 ℃以下只观察到HNF的缓慢分解, 在燃烧的HNF表面有一层熔融层, 通过IR检测到唯一的固体产物为硝酸铵; 在125~260 ℃温度范围内, 在气相中可检测到NF(气), 肼(气), N2O, H2O, NF, CO2和硝仿铵(ANF)等气溶胶而未发现NH3(气)。
虽然Klerk[7]曾通过DSC测试并利用Kissinger[6]法计算了HNF的热分解活化能Ek和指前因子Ak, 也由真空安定性实验评价过HNF的热安全性[1], 但HNF的热分解动力学机理函数和其他热力学参数, 以及热安全参数的具体计算却鲜见报道。本研究用真空安定性试验(VST)、差示扫描量热法(DSC)和热重法(TG)研究HNF的热分解特性, 根据HNF在升温速率为5, 10, 15, 20 ℃·min-1时DSC曲线的峰温和TG曲线的分解深度, 分别用Kissinger法和Ozawa法[8-9]计算HNF的热分解表观活化能、指前因子、机理函数和动力学方程, 进而用Zhang-Hu-Xie-Li[10]等方法计算热力学参数和热安全性参数, 包括活化自由能ΔG≠、活化焓ΔH≠、活化熵ΔS≠, 自发火温度Tbpo和自加速分解温度TSADT, 为HNF在推进剂中的应用提供理论和实验依据。
2 实验部分 2.1 样品的制备HNF为项目组实验室自制样品, 其制备方法见文献[11]。HNF为橙黄色针状晶体, 纯度为99.78%。
真空安定性试验(VST)需要将HNF样品经粉碎过SSW1.4/0.71的实验筛后制得试样。
2.2 仪器和实验条件VST:真空安定性实验装置71L168。按照GJB772A-1997方法501.1的要求, 用汞压力计法进行测试。
将20g样品在53 ℃及0.012MPa条件下于真空干燥箱内抽真空2 h。测试条件为:加热温度60 ℃, 加热时间48 h。
DSC: DSC823e差示扫描量热仪, 瑞士METTLER TOLED公司。样品质量为(0.5800±0.02) mg, 升温区间为30~200℃, 升温速率分别为5, 10, 15, 20 ℃·min-1, 气氛为流动N2, 流速为30 mL·min-1。
TG: TGA/SDTA851e热分析仪, 瑞士METTLER TOLED公司。样品质量为(0.6000±0.02) mg, 升温区间为30~200 ℃, 升温速率分别为5, 10, 15, 20 ℃·min-1, 气氛为流动N2, 流速为30 mL·min-1。
3 结果与讨论 3.1 HNF的热分解特性 3.1.1 真空安定性试验(VST)结果HNF的热分解温度较低, 根据文献[2]真空安定性试验选择的条件为:样品质量约5 g, 加热温度60 ℃, 加热时间48 h。3次平行实验结果见表 1。
| 表 1 由VST得到的HNF的试验结果 Tab.1 Test results of HNF obtained by vacnum stability test(VST) |
根据GJB772A-1997方法501.1的标准, VST条件下的气体放气量不超过2 mL·g-1时, 则认为安定性合格。文献[12]综述了国内外的研究成果, 给出的HNF的放气量为2~10 mL·g-1。而在与本文相同加热温度和加热时间的条件下, 文献[2]给出用不同重结晶方法得到的HNF的放气量均小于0.5 mL·g-1。本研究中HNF的VST三次实验结果平均值为0.41 mL·g-1, 表明HNF具有良好的热安定性。
3.1.2 差示扫描量热分析(DSC)结果测定了HNF不同升温速率下(5, 10, 15, 20 ℃·min-1)的DSC曲线, 见图 1。由图 1获得HNF热分解的特征参数见表 2。
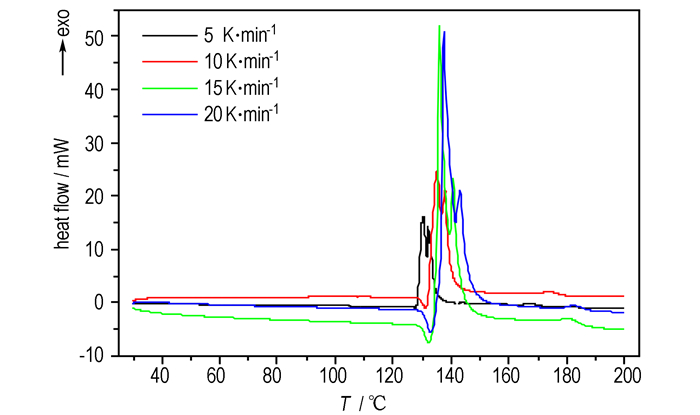
|
图 1 不同升温速率下HNF的DSC曲线 Fig.1 DSC curves of HNF at different heating rates |
| 表 2 不同升温速率下HNF的DSC结果 Tab.2 DSC results of HNF at different heating rates |
从图 1可看出, 随着升温速率的增加, DSC曲线的放热峰向高温方向移动, 且四条曲线峰形相似。在HNF的加热过程中(5, 10, 15, 20 ℃·min-1), 第一个吸热峰表明HNF在127.58~133.00 ℃之间发生了熔化。从升温速率为5 ℃·min-1的DSC曲线中未观察到明显的熔融峰(吸热峰), 这可能是因为HNF熔融吸热过程被紧跟着的快速放热分解过程所掩盖。继续加热, HNF出现了两个剧烈的放热峰, 这表明HNF发生了快速分解反应, 这与文献[13]的结果较吻合。
3.1.3 热重(TG)分析结果HNF在升温速率分别为5, 10, 15, 20 ℃·min-1时的TG曲线见图 2, 升温速率为5 ℃·min-1的TG-DTG曲线见图 3。
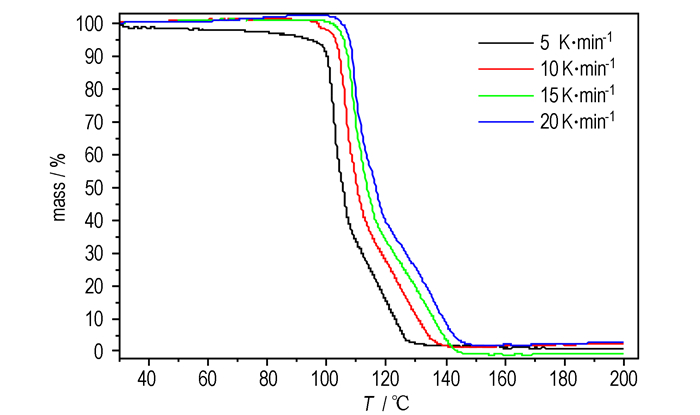
|
图 2 不同升温速率下HNF的TG曲线 Fig.2 TG curves of HNF at different heating rates |
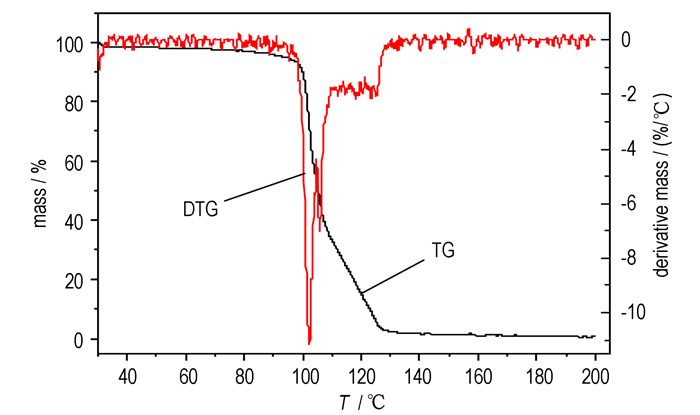
|
图 3 5 ℃·min-1时HNF的TG-DTG曲线 Fig.3 TG-DTG curve of HNF at 5 ℃·min-1 |
从图 2可知, 不同升温速率下HNF的TG曲线趋势相似, 升温速率为5, 10, 15, 20 ℃·min-1的HNF分别于130.33, 142.33, 147.25, 151.33 ℃时分解完毕, 其失重百分数随温度的升高而不再变化, 表明未再有质量的损失。整理数据可得它们最后的质量损失分别为99.33%, 97.66%, 99.99%, 97.23%, 几乎都接近于100%。以5 ℃·min-1时的TG-DTG为例, 从图 3可明显看出, HNF的热分解过程主要为两个阶段。第一阶段温度区间为30~110 ℃, 质量损失为66.76%;第二阶段温度区间为110~200 ℃, 质量损失为32.57%。
3.2 动力学参数计算 3.2.1 Kissinger法根据HNF在升温速率分别为5, 10, 15, 20 ℃·min-1时DSC曲线的峰温, 用Kissinger公式[6]通过线性回归求得热分解动力学参数。
| $ {\rm{ln}}\frac{{{\beta _i}}}{{T_{{\rm{p}}i}^2}} = {\rm{ln}}\frac{{{A_{\rm{k}}}R}}{{{E_{\rm{k}}}}} - \frac{{{E_{\rm{k}}}}}{{R{T_{{\rm{p}}i}}}}\;\;\;\;\;\;i = 1, 2, 3, 4 $ | (1) |
式中, βi为试样升温速率, ℃·min-1; Tpi为DSC曲线上的第一个峰温, K; Ek为表观活化能, J·mol-1; Ak为指前因子, s-1; R为理想气体常数, J·mol-1·K-1。由lnβi/Tpi2~1/Tpi的关系, 经回归分析求Ek的值。用第一个峰温计算得到HNF的表观活化能Ek=257.10 kJ·mol-1, Ak=1.74×1033s -1。
3.2.2 Ozawa法[8-9]通过不同升温速率下的TG曲线用非等温法进行热分解动力学研究时, 常用的Ozawa公式为:
| $ {\rm{lg}}\beta = {\rm{lg}}[\frac{{A{E_{\rm{a}}}}}{{RF(\alpha )}}] - 2.315 - 0.4567\frac{{{E_{\rm{a}}}}}{{RT}} $ | (2) |
式中, β为升温速率, ℃·min-1; A为指前因子, s-1; α为炸药反应深度; R为理想气体常数, J·mol-1·K-1; Ea为表观活化能, J·mol-1; T为温度, K; F(α)为机理函数的积分形式。
如果选择相同的α, lgβ与1/T呈线性关系, 由直线的斜率计算活化能, 并用来求解热分解的机理函数。
根据Doyle法[8], (2)式可变换为:
| $ {\rm{lg}}F\left( \alpha \right) = {\rm{lg}}[\frac{{A{E_{\rm{a}}}}}{{R\beta }}] - 2.315 - 0.4567\frac{{{E_{\rm{a}}}}}{{RT}} $ | (3) |
对任何热分解机理函数, lgF(α)与1/T呈线性关系。对某个假设的反应机理函数, 若通过Doyle法求得的热分解活化能与Ozawa法求得的活化能接近, 且线性相关系数好, 则可由此获得最可几热分解反应机理函数。
本实验的升温速率分别为5, 10, 15, 20 ℃·min-1, 升温的温度区间为30~200 ℃。从TG曲线对应的失重台阶来看, HNF热分解主要分为两个阶段, 分别位于反应深度为0.2~0.65和0.65~0.8。对于热分解的第一阶段(α=0.2~0.65), 根据HNF的热重曲线求出反应深度分别为0.2, 0.25, 0.3, 0.35, 0.4, 0.45, 0.5, 0.55, 0.6, 0.65时所对应的分解温度T。根据公式(2)和试验数据对lgβ与1/T进行线性拟合, 由直线斜率获得表观活化能Ea, 计算结果见表 3。
| 表 3 由Ozawa法得到的HNF的热分解反应活化能(α=0.20~0.65) Tab.3 Activation energy of the thermal decomposition reaction in the α range of 0.20~0.65 of HNF obtained by Ozawa′s method |
对假设的炸药热分解反应机理函数的相应lgF(α)与1/T进行线性回归分析, 线性拟合结果表明:对于HNF的热分解, HNF在反应深度为0.2~0.65阶段的热分解属于随机成核和随后生长, An, JMA(2)机理[14], 此时求得的的活化能与(2)式所得的活化能最为接近, 且相关系数好, 计算结果详见表 4。
| 表 4 lgF(α)-1/T的线性拟合结果(α=0.20~0.65) Tab.4 Liner fitting result of lg F(α)-1/T in the α range of 0.20~0.65 |
用同样的方法(Ozawa法)对第二个阶段(α=0.65~0.8)进行表观活化能的计算, 根据HNF的热重分析曲线求出反应深度分别为0.65, 0.7, 0.75, 0.8时所对应的分解温度T, 计算结果见表 5。线性拟合结果表明, 对于HNF的热分解, HNF在反应深度为0.65~0.8阶段的热分解属于随机成核和随后生长, n=2机理[14], 此时求得的的活化能与(2)式所得的活化能最为接近, 且相关系数好, 计算结果详见表 6。
| 表 5 由Ozawa法得到的HNF的热分解反应活化能(α= 0.65~0.80) Tab.5 Activation energy of the thermal decomposition reaction in the α range of 0.65~0.80 of HNF obtained by Ozawa′s method |
| 表 6 lgF(α)-1/T线性拟合结果(α=0.65~0.8) Tab.6 Liner fitting results of lgF(α)-1/T in the α range of 0.65~0.80 |
线性回归的分析结果表明, HNF在反应深度为0.2~0.65阶段的热分解属于随机成核和随机生长, An, JMA(2)机理。反应机理的微分形式为F(α)=2(1-α)[-ln(1-α)]1/2, 热分解动力学方程为:
| $ \begin{array}{l} {\rm{d}}\alpha /{\rm{d}}t = kf\left( \alpha \right) = A{e^{ - \frac{E}{{RT}}}}f\left( \alpha \right) = 5.14 \times {10^{21}} \times \\ \;\;\;\;\;\;\;\;\;\;\left( {1 - \alpha } \right){{\rm{[}}-{\rm{ln}}\left( {1-\alpha } \right)]^{\frac{1}{2}}}{\rm{exp}}( - \frac{{1.81 \times {{10}^4}}}{T}) \end{array} $ | (4) |
HNF在反应深度为0.65~0.8阶段的热分解属于随机成核和随机生长, n=2机理, 反应机理的微分形式为F(α)= 1/2(1-α)[-ln(1-α)]-1。热分解动力学方程为:
| $ \begin{array}{l} {\rm{d}}\alpha /{\rm{d}}t = kf\left( \alpha \right) = A{e^{ - \frac{E}{{RT}}}}f\left( \alpha \right) = 3.30 \times {10^{14}} \times \\ \;\;\;\;\;\;\;\;\;\;\;\left( {1 - \alpha } \right){{\rm{[}}-{\rm{ln}}\left( {1-\alpha } \right)]^{{\rm{ - }}1}}{\rm{exp}}( - 1.33 \times {10^4}/T) \end{array} $ | (5) |
根据文献[15], HNF的热力学参数, 包括活化自由能ΔG≠, 活化焓ΔH≠和活化熵ΔS≠可按下式计算:
| $ {A_{\rm{k}}}{\rm{exp}}( - \frac{{{E_{\rm{k}}}}}{{RT}}) = \frac{{{k_{\rm{B}}}{T_{{\rm{po}}}}}}{h}{\rm{exp}}( - \frac{{\mathit{\Delta }{G^ \ne }}}{{R{T_{{\rm{po}}}}}}) $ | (6) |
| $ \Delta {H^ \ne } = {E_{\rm{k}}} - R{T_{{\rm{po}}}} $ | (7) |
| $ \Delta {G^ \ne } = \Delta {H^ \ne } - {T_{{\rm{po}}}}\Delta {S^ \ne } $ | (8) |
式中, Ak为指前因子, s-1; Ek为表观活化能, J·mol-1; Tpo为加热速率趋于零时的外推峰温, K; kB为Boltzman常数, 1.3807×10-23J·K-1; h为plank常数, 6.626×10-34J·s。
计算HNF可得分解反应的活化自由能ΔG≠= 103.37 kJ·mol-1, 活化焓ΔH≠= 253.82 kJ·mol-1以及活化熵ΔS≠=380.78 J·K-1·mol-1。
3.4 热安全性参数计算根据GJB772A-1997方法505.1, 按下式线性回归计算加热速率趋于零时的外推峰温:
| $ {T_{{\rm{pi}}}} = {T_{{\rm{po}}}} + b{\beta _i} + c\beta _i^2 + d\beta _i^3\;\;\;\;\;\;\;\;\;\;i = 1, 2, 3, 4 $ | (9) |
式中,βi为试样升温速率, ℃·min-1; Tpo为加热速率趋于零时DSC曲线上的外推峰温, K。
将峰温及加热速率带入(9)式中, 则求得, Tpo=395.10 K。
根据GJB772A-1997方法505.1中的Zhang-Hu-Xie-Li法及文献[10], 按下式计算自发火温度:
| $ {T_{{\rm{bpo}}}} = \frac{{{E_{\rm{k}}} - \sqrt {E_{\rm{k}}^2 - 4{E_{\rm{k}}}R{T_{{\rm{po}}}}} }}{{2R}} $ | (10) |
式中,Ek为用峰温计算得到的表观活化能, J·mol-1; R如式(1); Tpo如式(9); Tbpo为用Zhang-Hu-Xie-Li法处理的Ek和Tpo值得到的试样的自发火温度, K。将Ek及Tpo带入(10)式中, 计算可得Tbpo= 400.28 K。
根据文献[16], 自加速分解温度可按下式计算:
| $ {T_{{\rm{SADT}}}} = {T_{{\rm{bpo}}}} - \frac{{RT_{{\rm{bpo}}}^2}}{{{E_{\rm{k}}}}} $ | (11) |
式中,TSADT为自加速分解温度, K; Tbpo, Ek如式(10)。将Ek及Tbpo带入(11)式中, 计算可得TSADT=395.10 K。
4 结论(1) 通过真空安定性试验(VST), 测得HNF在60℃, 48h条件下的放气量为0.41mL/g。符合安定性的标准, 表明HNF有较好的热安定性。
(2) 由非等温条件下的TG-DTG曲线可知, HNF热分解有主要有两个阶段。其中, 第一个阶段属于随机成核和随后生长, An, JMA(2)机理, 其机理函数为F(α)= 2(1-α)[-ln(1-α)]1/2; 第二个阶段属于随机成核和随后生长, n=2机理, 反应机理的微分形式为F(α)= 1/2(1-α)[-ln(1-α)]-1。
(3) 由非等温DSC曲线通过Kissinger法和Zhang-Hu-Xie-Li法计算得到活化能Ek=257.10 kJ·mol-1, 指前因子Ak=1.74×1033 s -1, 自发火温度Tbpo=400.28 K, 自加速分解温度TSADT =395.10 K以及活化自由能ΔG≠ =103.37 kJ·mol-1, 活化焓ΔH≠= 253.82 kJ·mol-1和活化熵ΔS≠=380.78 J·K-1·mol-1。
| [1] |
Klerk W P C, Heijden A E D M, Veltmans W H M. Thermal analysis of the high-energetic material HNF[J].
Journal of Thermal Analysis and Calorimetry, 2001, 64: 973-985. DOI:10.1023/A:1011535332434 |
| [2] |
SchÖyer H F R, Veltmans W H M, Louwers J, et al. Overview of the development of hydrazinium nitroformate[J].
Journal of Production and Power, 2002, 18(1): 131-137. |
| [3] |
李上文, 高凤起, 罗阳, 等. 国外含AND或HNF的高能复合推进剂[J].
含能材料, 2004, 12(增刊): 137-142. LI Shang-wen, GAO Feng-qi, LUO Yang, et al. High energy composite propellant containing AND and HNF at abroad[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2004, 12(suppl.): 137-142. |
| [4] |
Dragomir O E, Tummers M J, Veen E H, et al. Condensed phase decomposition and gas phase combustion of hydrazinium nitroformate[J].
Combustion and Flame, 2009, 156: 1810-1817. DOI:10.1016/j.combustflame.2009.06.021 |
| [5] |
Willams G K, Brill T B. Thermal decomposition of energetic materials 67.hydrazinium nitroformate (HNF) rates and pathways under combustionlike conditions[J].
Combustion and Flame, 1995, 102(3): 418-426. DOI:10.1016/0010-2180(94)00283-X |
| [6] |
Kissinger H E. Reaction kinetics in differential thermal analysis[J].
Analytical Chemistry, 1957, 29(11): 1702-1706. DOI:10.1021/ac60131a045 |
| [7] |
Klerk W P C, Popescu C, Heijden A E D M. Study on the decomposition kinetics of FOX-7 and HNF[J].
Journal of Thermal Analysis and Calorimetry, 2003, 72: 955-966. DOI:10.1023/A:1025038819979 |
| [8] |
何志伟, 高大元, 刘祖亮. 2,6-二氨基-3,5-二硝基吡啶-1-氧化物及其黏结炸药的热分解动力学[J].
火炸药学报, 2009, 32(2): 32-35. HE Zhi-wei, GAO Da-yuan, LIU Zu-liang. Thermal decomposition kinetics of 2,6-diamino-3,5-dinitropyridine-1-oxide and its formulation explosives[J]. Chinese Journal of Explosives & Propellant, 2009, 32(2): 32-35. |
| [9] |
马晓明, 李斌栋, 吕春绪, 等. 无氯TATB的合成及其热分解动力学[J].
火炸药学报, 2009, 32(6): 24-27. MA Xiao-ming, LI Bin-dong, Lü Chun-xu, et al. Synthesis and thermal decomposition kinetics of TATB without chloride[J]. Chinese Journal of Explosives& Propellant, 2009, 32(6): 24-27. |
| [10] |
Zhang Tong-lai, Hu Rong-zu, Xie Yi, et al. The estimation of critical temperatures of thermal explosion for energetic materials using non-isothermal DSC[J].
Thermochimica Acta, 1994, 244(3): 171-176. |
| [11] |
汪慧英, 文亮, 杨红伟, 等. 硝仿肼的合成工艺与晶体结构[J].
火炸药学报, 2013, 36(6): 43-46. WANG Hui-ying, WEN Liang, YANG Hong-wei, et al. Synthesis technique and crystal structure of HNF[J]. Chinese Journal of Explosives& Propellant, 2013, 36(6): 43-46. |
| [12] |
丁黎, 陆殿林. 硝仿肼及其推进剂的研究进展[J].
火炸药学报, 2003, 26(3): 35-38. DING Li, LU Dian-lin. Advance in hydrazinium nitroformate(HNF) and HNF based propellant[J]. Chinese Journal of Explosives& Propellant, 2003, 26(3): 35-38. |
| [13] |
Tummers M J, Heijden A E D M, Veen E H. Selection of burning rate modifiers for hydrazinium nitroformate[J].
Combustion and Flame, 2012, 159: 882-886. DOI:10.1016/j.combustflame.2011.08.010 |
| [14] |
胡荣祖, 史启祯.
热分析动力学[M]. 北京: 科学出版社, 2001.
HU Rong-zu, SHI Qi-zhen. Thermal analysis kinetics[M]. Beijing: Science Press, 2001 |
| [15] |
胡荣祖, 高红旭, 赵凤起, 等. 1,1'-二甲基-5,5'-偶氦四唑-水合物和2,2'-二甲基-5,5'-偶氮四唑的热安全性[J].
含能材料, 2011, 19(2): 126-131. HU Rong-zu, GAO Hong-xu, ZHAO Feng-qi, et al. Thermal safety of 1,1'-dimethyl-5,5'-azotetrazole and 2,2'-dimethyl-5,5'-azotetrazole[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2011, 19(2): 126-131. |
| [16] |
汤崭, 杨利, 乔小晶, 等. HMX热分解动力学与热安全性研究[J].
含能材料, 2011, 19(4): 396-400. TANG Zhan, YANG Li, QIAO Xiao-jing, et al. On thermal decomposition kinetics and thermal safety of HMX[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2011, 19(4): 396-400. |
Thermal decomposition characteristics and kinetic behaviors of HNF were studied by vacuum stability test(VST), differential scanning calorimetry (DSC) and thermogravimetry (TG). The kinetic equations describing the two exothermic decomposition reaction processes of HNF were presented.




