2. 南京市第十三中学, 江苏 南京 210094
2. Nanjing No.13 Middle School, Nanjing 210094, China
1, 1-二氨基-2, 2-二硝基乙烯(FOX-7)是一种性能优良的低感高能炸药, 国内外对其制备已进行了广泛的研究, 目前最佳的合成方法是以2-甲基嘧啶-4, 6-二酮(MPO)经硝化再水解制得FOX-7, 该工艺步骤简单、产率较高, 且瑞典已将其放大到7 kg/批[1-4]。存在的不足是其副产物二硝基甲烷沸点低(39~40 ℃)、性质不稳定。由于两个硝基的吸电子效应, 二硝基甲烷呈较强的酸性, Na和K盐具有相对较好的稳定性, 室温下可放置至少数周。相较于极易溶于水的Na盐, K盐在水中溶解度较小, 更易于结晶[5-7]。对二硝基甲烷进行回收利用, 将其制备成性能较为稳定的二硝基甲烷钾盐(KDNM), 不仅可以消除生产安全隐患, 而且间接降低了FOX-7的生产成本, 提高了生产效益。
近年来, 多硝基嘧啶环化合物是含能材料研究的热点之一。1, 3, 5, 5-四硝基六氢嘧啶(DNNC)是一种性能优良的高能化合物。与高氯酸铵(AP)相比, DNNC燃烧时不产生氯化氢, 可作为高能、清洁、低特征信号的氧化剂用于推进剂中; 与黑索今(RDX)相比, 其能量较高, 感度较低, 且氧平衡与热稳定性都优于RDX, 可用做混合炸药的含能增塑剂[8]。目前, DNNC主要合成方法是以2, 2-二硝基-1, 3-丙二醇、胺类化合物和甲醛经Mannich缩合再硝解制得[9-11]。李清霞等[12]以叔丁胺做胺组分进行Mannich缩合反应, 产率为71%, 并通过同位素示踪法推测反应机理为二硝基甲烷、叔丁胺与甲醛三组分的Mannich缩合; 张丽洁等[13]继而对该步反应进行优化, 产率达到87%。总的来说, 硝基甲烷制备2, 2-二硝基-1, 3-丙二醇制备方法主要有硝酸银氧化法与过硫酸钠氧化法, 但硝酸银氧化法制备过程中使用的硝酸银价格昂贵, 即使回收利用, 成本也较高, 无法大规模生产[14]。过硫酸钠氧化法虽然价格合理, 但使用量较大, 且产率较低仅为24.1%[15]。这都限制了2, 2-二硝基-1, 3-丙二醇以及DNNC的大规模生产。
基于此, 本研究对FOX-7制备过程中的副产物二硝基甲烷进行回收利用, 制备成性能稳定的KDNM, 代替2, 2-二硝基-1, 3-丙二醇, 直接与甲醛、叔丁胺进行Mannich缩合制得1, 3-二叔丁基-5, 5-二硝基六氢嘧啶, 再以混酸硝解制得DNNC, 并研究了pH值、溶剂、温度对Mannich缩合反应的影响以及硝化体系的选择对硝解反应的影响。
2 实验部分 2.1 试剂与仪器试剂: 2-甲基嘧啶-4, 6-二酮, 纯度99%, 湖北远成赛创科技有限公司; 氢氧化钾、叔丁胺, 分析纯, 成都市科龙化工试剂厂; 甲醛, 分析纯, 西陇化工股份有限公司。甲基叔丁基醚、浓硫酸、发烟硝酸, 分析纯, 国药集团化学试剂有限公司。
仪器: Bruker Avance Ⅲ(500 MHz)核磁共振氢谱仪(德国Bruker公司); Nicolet红外光谱仪(美国Thermo Fisher公司); Finnigan TSQ Quantum ultra AM型质谱仪(美国Thermo Finnigan公司); X-5纤维熔点测定仪(南京嘉美伦科学仪器有限公司)。
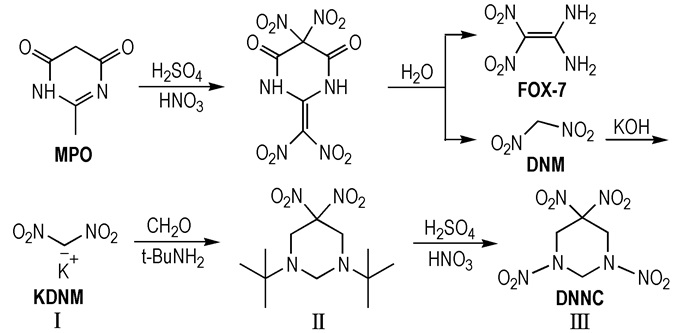
2.2 合成路线DNNC的合成路线见Scheme 1。
|
Scheme1 The synthesis route of DNNC |
将40 mL浓硫酸倒入装有搅拌器、温度计的三口烧瓶中, 搅拌下分批加入10.0 g (78 mmol)2-甲基嘧啶-4, 6-二酮(MPO), 并控制温度低于40 ℃。待其完全溶解后, 用冰水浴将温度降至0~5 ℃以下, 缓慢滴加15 mL发烟硝酸, 并维持温度不超过10 ℃。滴加完毕后保温30 min, 而后升温至15 ℃继续反应3 h, 反应结束后将得到的混合物缓慢倒入搅拌下的400 mL冰水中, 搅拌至无气泡产生, 过滤、干燥得黄色固体产物FOX-7 10.4 g, 产率90.1%(以MPO计)。分别用30 mL甲基叔丁基醚萃取滤液3次, 合并有机相, 用10%氢氧化钾水溶液调节pH值至8~9, 加热蒸馏回收甲基叔丁基醚, 静置冷却、过滤、干燥得黄色针状晶体(Ⅰ), 4.87 g, 产率43.4%(以MPO计)。IR(ν/cm-1): 3146, 1458, 1436, 1406, 1365, 1288, 1176, 1080, 1002, 785, 742, 683。
2.3.2 1, 3-二叔丁基-5, 5-二硝基六氢嘧啶(Ⅱ)的制备室温下, 将2.88 g(20 mmol)(Ⅰ)加入到40 mL10%甲醇水溶液中, 磁力搅拌, 加入5.68 g(70 mmol)37%的甲醛水溶液, 搅拌至溶液澄清, 滴加2.93 g(40 mmol)叔丁胺, 再往溶液中滴加盐酸调节pH值至8。升温至50 ℃, 反应3 h。过滤, 干燥, 得白色固体产物(Ⅱ) 4.91 g, 产率85.3%, m.p. 77~78 ℃。1H NMR(DMSO-d6, 500 MHz), δ: 3.61(s, 4H, CH2), 3.45(s, 2H, CH2), 1.05(s, 18H, t-Bu); IR(ν/cm-1): 2962, 1562, 1365, 1330, 1305, 1270, 1236, 1205, 1035, 852, 809, 763; ESI-MS, m/z: 289[M+H]+。
2.3.3 1, 3, 5, 5-四硝基六氢嘧啶(Ⅲ)的制备将20 mL浓硫酸倒入装有搅拌器、温度计的三口烧瓶中, 搅拌下分批加入2.88 g(10 mmol) (Ⅱ), 并控制温度低于30 ℃。待其完全溶解后, 冰水浴降温至0 ℃, 缓慢滴加10 mL硝酸, 并维持温度在0~5 ℃。滴加完毕后, 保温1 h后, 升温至室温继续反应2 h。反应结束后, 倒入50 mL冰水中, 过滤、洗涤、干燥得到白色固体(Ⅲ)。再将白色固体用无水乙醇重结晶得到白色针状晶体(Ⅲ)2.46 g, 产率92.5%, m.p. 152~154 ℃。1H NMR(DMSO-d6, 500 MHz), δ: 6.11(s, 2H, CH2), 5.35(s, 4H, CH2); IR(ν/cm-1): 3034, 2955, 1573, 1545, 1377, 1314, 1293, 1276, 1250, 893, 805, 756; ESI-MS, m/z: 328[M+NO3]-, 303, 301[M+Cl]-, 265[M-H]-。
3 结果与讨论 3.1 二硝基甲烷回收过程优化在文献[1]的基础上, 将原先的无水乙醚萃取改为甲基叔丁基醚萃取, 有利于其公斤级/批规模的安全生产, 而将氢氧化钾醇溶液改为氢氧化钾水溶液来制备KDNM, 尽管滴加过程中出现了分层现象, 但KDNM可溶于水中, 而后的升温不仅可以回收甲基叔丁基醚, 而且对KDNM重结晶得到的产物由文献[1]的淡黄色无定型粉末转化为黄色长针状的晶体。与淡黄色无定型粉末产物相比, 黄色长针状晶体的纯度更高, 稳定性更好, 不易于分解, 有利于KDNM的贮藏与使用。
3.2 Mannich反应条件优化 3.2.1 pH值对Mannich反应的影响Mannich缩合反应中, 酸组分的亲核性与胺的亲核性对pH值的依赖性不同, 所以反应状况受pH值的影响很大, 每个Mannich反应都有一个最佳的pH值。在二硝基甲烷钾盐:甲醛:叔丁胺的摩尔比为1.0:3.5:2.0; 10%甲醇水溶液为溶剂, 室温下用盐酸调节pH值, 随后升温至50 ℃, 反应3 h的条件下, 研究pH值对Mannich反应的影响见表 1。由表 1可知, 在不加酸调节pH值时, 体系的pH值为12, 反应产物的产率很低, 主要副产物为水溶性的1-叔丁氨基-2, 2-二硝基乙烷钾盐与2, 2-二硝基乙醇钾, 难于进一步成环。随着酸的滴加, 体系pH值逐渐下降, 当pH值为9时, 体系中开始生成难溶性中间体1-叔丁氨基-2, 2-二硝基乙烷, 使得溶液变浑浊, 但也有利于进一步成环生成产物; 当pH值降至8时, 反应产率最高; 而当pH值为7时, 溶液颜色呈橙红色, 产率下降, 可能原因是产物具有弱碱性, 中性以及酸性都不利于其环合生成。因此, 最优pH值为8。
| 表 1 pH值对Mannich反应的影响 Tab.1 Effect of pH value on Mannich reaction |
在二硝基甲烷钾盐:甲醛:叔丁胺的摩尔比为1.0:3.5:2.0, 室温下用盐酸调节pH值至8, 随后升温至50 ℃, 反应3 h的条件下, 溶剂对Mannich反应的影响见表 2。由表 2可知, 随着溶剂极性的增大, 反应的产率逐步提高(H2O>CH3OH>C2H5OH)。这主要是由于有反应中间体1-叔丁氨基-2, 2-二硝基乙烷的生成, 而不同溶剂对于反应中间体的溶解性不同, 从而影响其进一步环合生成产物。1-叔丁氨基-2, 2-二硝基乙烷通常认为是以两性离子盐的形式存在, 其在不同溶剂中的溶解性为H2O>CH3OH>C2H5OH。因此, 其在水相中反应得到的产率相对最高。而当以甲醇水溶液作混合溶剂时, 少量的甲醇可以加入, 有利于减少产物生成时发生团聚、结块现象, 所以10%甲醇水溶液时产率达到最高为85.3%, 甲醇量再增加, 反应的产率反而降低。因此, 最优的溶剂为10%甲醇水溶液。
| 表 2 溶剂对Mannich反应的影响 Tab.2 Effect of solvents on Mannich reaction |
在二硝基甲烷钾盐:甲醛:叔丁胺的摩尔比为1.0:3.5:2.0; 10%甲醇水溶液为溶剂, 室温下用盐酸调节pH值至8, 随后升温并反应3 h的条件下, 温度对Mannich反应的影响见表 3, 由表 3可知, 当温度较低时, 反应的产率较低, 而随着温度上升, 产率逐步上升。这主要是因为温度的升高, 提高了溶液中分子的运动, 增加了分子间有效碰撞次数, 有利于生成稳定的1, 3-二叔丁基-5, 5-二硝基六氢嘧啶。当温度为50 ℃时, 其产率最高, 为81.2%, 继续升温, 产率反而下降, 这可能是因为过高的温度导致1-叔丁氨基-2, 2-二硝基乙烷中C—C键的断裂, 同时, 温度过高, 也可能使可能使1-叔丁氨基-2, 2-二硝基乙烷脂化。因此, 最优温度为50 ℃。
| 表 3 温度对Mannich反应的影响 Tab.3 Effect of temperature on Mannich reaction |
在1, 3-二叔丁基-5, 5-二硝基六氢嘧啶用量2.88 g, 控制反应温度在0~5 ℃下进行硝化反应, 随后保温1 h, 升温至室温反应2 h的条件下, 硝解体系对硝化反应的影响见表 4。
| 表 4 硝解体系对硝化反应的影响 Tab.4 Effect of nitrolysis systems on nitrification reaction |
由表 4可知, 以20 mL 98% H2SO4, 10 mL HNO3进行硝化得到的产率最高, 为92.5%。这主要是因为与10 mL 98% HNO3直接硝解相比, 20 mL 98% H2SO4, 10 mL HNO3的混酸体系中, 浓硫酸作为溶剂溶解中间体Ⅱ, 使其分散均匀, 有利于硝酸滴加时的散热, 而98%硝酸直接硝解时, 可能存在局部的过热等; 与20 mL Ac2O, 10 mL HNO3体系相比, 浓硫酸的吸水性更强, 更有利于硝酰阳离子的生成与进攻。因此, 最优硝解体系为20 mL 98% H2SO4, 10 mL HNO3。
4 结论(1) 对FOX-7生产过程中的副产物二硝基甲烷进行回收, 制成长针状晶体KDNM, 不仅消除了生产中的安全隐患, 而且晶态的KDNM纯度高、性质稳定, 将其进一步经Mannich缩合再硝解制得DNNC。
(2) 在KDNM:甲醛:叔丁胺的摩尔比为1.0:3.5:2.0, 反应3 h条件下, Mannich缩合反应的最优条件为:以10%甲醇水溶液做溶剂, 反应体系的pH=8, 反应温度为50 ℃, 其产率达到85.3%。
(3) 选用不同的硝解体系对1, 3-二叔丁基-5, 5-二硝基六氢嘧啶进行硝解制备DNNC, 得到最优的硝解体系为20 mL 98% H2SO4与10 mL HNO3的混合体系, 其产率达到92.5%。
| [1] |
Anniyappan M, Talawar M B, Gore G M, et al. Synthesis, characterization and thermolysis of 1, 1-diamino-2, 2-dinitroethylene (FOX-7) and its salts[J].
Journal of Hazardous Materials, 2006, 137(2): 812-819. DOI:10.1016/j.jhazmat.2006.03.034 |
| [2] |
Astrat'ev A. A, Dashko D. V, Mershin A. Y, et al. Some specific features of acid nitration of 2-substituted 4, 6-dihydroxypyrimidines. nucleophilic cleavage of the nitration products[J].
Russian Journal of Organic Chemistry, 2001, 37(5): 729-733. DOI:10.1023/A:1012568305472 |
| [3] |
付秋菠, 舒远杰, 黄奕刚, 等. 1, 1-二氨基-2, 2-二硝基乙烯的合成与性能研究[J].
有机化学, 2006, 26(10): 1409-1413. FU Qiu-bo, SHU Yuan-jie, HUANG Yi-gang, et al. Synthesis and properties of 1, 1-diamino-2, 2-dinitroethylene[J]. Chinese Journal of Organic Chemistry, 2006, 26(10): 1409-1413. DOI:10.3321/j.issn:0253-2786.2006.10.012 |
| [4] |
Nikolaj V L, Martin J, Erik H, et al. On the synthesis of 1, 1-diamino-2, 2-dinitroethene (FOX-7) by nitration of 4, 6-dihydroxy-2-methylpyrimidine[J].
Organic Process Research & Development, 2007, 11: 56-59. |
| [5] |
Vytautas G, Allen M. Dinitromethane[J].
The Journal of Organic Chemistry, 1978, 43(18): 3485-3488. DOI:10.1021/jo00412a014 |
| [6] |
曹丹, 宋靳红, 黄海丰, 等. 二硝基甲烷含能离子盐的合成与性能及其热动力学分析[J].
兵工学报, 2012, 33(5): 560-565. CAO Dan, SONG Jin-hong, HUANG Hai-feng, et al. Synthesis and property of energetic dinitromethanide salt and their thermal decomposition reaction kinetics[J]. Acta Armamentarii, 2012, 33(5): 560-565. |
| [7] |
SUN Qian, WANG Xiao-hui, XU Kang-zhen, et al. Crystal structure and thermal behavior of potassium dinitromethane[J].
Chinese Journal of Energetic Materials, 2016, 24(9): 874-879. |
| [8] |
李猛, 赵凤起, 徐司雨, 等. 新型高氯酸铵替代物对固体推进剂能量性能的影响[J].
火炸药学报, 2016, 39(2): 86-91. LI Meng, ZHAO Feng-qi, XU Si-yu, et al. Effect of ammonium perchlorate replacements on energetic performance of solid propellant[J]. Chinese Journal of Explosives & Propellants, 2016, 39(2): 86-91. |
| [9] |
Dorothy A C, Horst G A. Nitrolysis of dialkyl tert-butylamines[J].
Journal of Organic Chemistry, 1982, 47: 2474-2476. DOI:10.1021/jo00133a047 |
| [10] |
Donald A, Clifford D. 1, 3, 5, 5-tetranitrohexahydropyrimidine(DNNC): US, 4346222[P], 1982.
|
| [11] |
Shackelford S A, Menapace J A, Goldman J F. Liquid state thermochemical decomposition of neat 1, 3, 5, 5-tetranitrohexahydropyrimidine(DNNC) and its DNNC-d2, DNNC-d4, DNNC-d6 structural isotopomers: Mechanistic entrance into the DNNC molecule[J].
Thermochimica Acta, 2007, 464: 42-58. DOI:10.1016/j.tca.2007.08.005 |
| [12] |
李清霞, 王鹏孟, 文君, 等. 1, 3-二叔丁基-5, 5-二硝基嘧啶烷的合成机理研究[J].
有机化学, 2010, 30(3): 409-413. LI Qing-xia, WANG Peng-meng, WEN Jun, et al. Reaction mechanism for the formation of 1, 3-ditertbutyl-5, 5-dinitrohexahydropyrimidine[J]. Chinese Journal of Organic Chemistry, 2010, 30(3): 409-413. |
| [13] |
张丽洁, 姬月萍, 陈斌, 等. 1, 3, 5, 5-四硝基六氢嘧啶的高收率合成[J].
含能材料, 2012, 20(4): 441-444. ZHANG Li-jie, JI Yue-ping, CHEN Bin, et al. Synthesis of 1, 3, 5, 5-tetranitrohexahydropyrimidine with high yield[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2012, 20(4): 441-444. |
| [14] |
Jadhav H S, Talawar M B, Dhavale D D, et al. Alternate method for synthesis of 1, 3, 3-trinitroazetidine(TNAZ): next generation melt castable high energy material[J].
Indian Journal of Chemical Technology, 2006, 13: 41-46. |
| [15] |
刘亚静, 陈斌, 刘卫孝, 等. 绿色方法合成2, 2-二硝基-1, 3-丙二醇[J].
含能材料, 2010, 18(6): 623-626. LIU Ya-jing, CHEN Bin, LIU Wei-xiao, et al. Green synthesis of 2, 2-dinitro-1, 3-propanediol[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2010, 18(6): 623-626. |

By-product dinitromethane in the manufacturing process of FOX-7 from 4, 6-dihydroxy-2-methylpyrimidine(MPO)was recovered, the long needle dinitromethane potassium salt (KDNM) crystal with stable property was prepared via neutralization using aqueous potassium hydroxide solution, 1, 3-dibutyl-5, 5-dinitrohexahydropyrimidine was prepared via Mannich condensation reaction using KDNM, formaldehyde and tert-butylamine as raw materials, and 1, 3, 5, 5-tetranitrohexahydropyrimidine (DNNC) was prepared via the nitrolysis of 1, 3-dibutyl-5, 5-dinitrohexahydropyrimidine with mixed acid system of concentrated sulfuric acid and concentrated nitric acid.




